
题目列表(包括答案和解析)
6.右图所示一项关于胚芽鞘的研究实验,下列关于实
验结果的叙述正确的是
A.M长得比N长
B.生长素使M细胞分裂强于N
C.M向左弯曲,N不弯曲
D.此实验说明单侧光促进生长素的产生
5.下列对生物进化理论的认识,正确的是
A.物种是生物繁殖和进化的基本单位
B.基因频率改变意味着新物种诞生
C.共同进化的过程也是生物多样性形成的过程
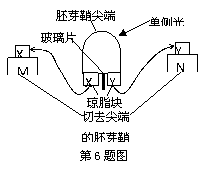 D.将西瓜用秋水仙素处理后形成的四倍体,与原来的二倍体之间不存在生殖隔离
D.将西瓜用秋水仙素处理后形成的四倍体,与原来的二倍体之间不存在生殖隔离
4.下列实验中,试剂与鉴定的物质及颜色变化对应不正确的一组是
A.双缩脲试剂-蛋白质-紫色;健那绿染液-线粒体-蓝绿色
B.苏丹Ⅲ染液-脂肪-橘黄色;碘液-淀粉-蓝色;重铬酸钾溶液-酒精-灰绿色
C.甲基绿-DNA-绿色;苏丹Ⅳ染液-脂肪-红色;斐林试剂-麦芽糖-砖红色
D.龙胆紫染液-染色体-紫色;吡罗红-DNA-红色
3.下面为细胞分裂过程示意图,据图分析可得出
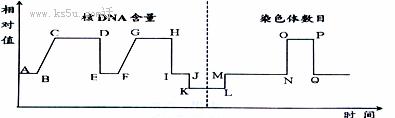
第3题图
A.在细胞分裂过程中,细胞体积明显增大的时期是OP段
B.若在A点将核DNA带上同位素标记后放在不含同位素标记的地方培养,则在GH段可检测到有放射性的脱氧核苷酸链占50%
C.在图中的GH段和OP段,细胞中含有的染色体组数是相等的
D.图中L点→M点所示的生理过程),与细胞膜的流动性有关
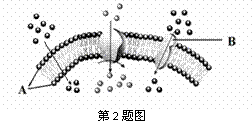
2.根据右图判断下列关于生物膜的叙述正确的是
A.分子A可识别“自己”和“非已”的成分
B.该膜依靠载体的协助,可以主动运输大分子和颗粒性物质
C.如用丙酮从某动物细胞中提取该膜,在空气-水界面上铺展开,则该界面等于该种细胞的表面积。
D.植物根细胞膜上分子B的种类越多,吸收的
矿质元素的离子种类就越多
1.关于细胞的结构和功能的叙述,正确的是
A.人的细胞中RNA的合成主要是在细胞质基质中进行的
B.将根尖生长点细胞用一定浓度的秋水仙素处理细胞会停止分裂
C.能进行蛋白质合成的细胞都具有核糖体
 D.蓝藻可以利用CO2在叶绿体中合成有机物
D.蓝藻可以利用CO2在叶绿体中合成有机物
34.实验题:(18分)
(1).(8分)
某一位同学自制了一个螺旋测微计,由于没有车床加工精密螺纹,他就找了一段标准的直径为0.6mm细钢丝,又找了一个均匀的细圆柱,在细圆柱上均匀地涂上万能胶,然后在细圆柱上紧密绕排细钢丝作为螺栓,在螺栓上再紧密绕排细钢丝和牛皮纸组成一个螺母,再通过其他工作,一个螺旋测微计终于制成了,问该螺旋测微计的固定刻度最小刻度为 mm,若将可动刻度分成30等份,则该自制螺旋测微计的准确度为 mm。
(2).(10分) 测量一块量程已知的电压表的内阻,器材如下:
A.待测电压表(量程3V,内阻约3KΩ)一块
 B.电流表(量程3A,内阻0.01Ω)一只
B.电流表(量程3A,内阻0.01Ω)一只
C.定值电阻(R=3KΩ,额定电流0.5A)一个
D.电池组(电动势略小于3V,内阻不计)
E.开关两只
F.导线若干。
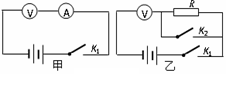
有一同学利用上面所给器材,进行如下实验操作:
①、(4分)为了更准确的测出该电压表内阻的大小,该同学设计了如图甲、乙两个实验的电路。你认为其中相对比较合理的电路是 (填“甲”或“乙”)电路。你的理由是: 。
②、(4分)用你选择的电路进行实验时,需要直接测量的物理量 ;用上述所测各物理量表示电压表内阻,其表达式应为Rv= 。

35(1).(10分)如图所示,若在湖水中固定一细长圆管,管内有一活塞,它的下端恰好位于水面上。活塞的底面积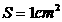 ,质量不计。大气压强为
,质量不计。大气压强为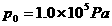 。现把活塞缓慢地提高
。现把活塞缓慢地提高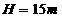 ,则拉力对活塞做了多少功?
,则拉力对活塞做了多少功?

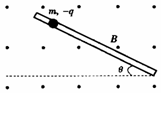 35(2).(10分)如图所示,质量为m的小球带电量为-q,将它套在一根与水平方向成θ角的足够长的直绝缘杆上,小球与杆间的动摩擦因数为μ,装置处于磁感应强度为B、方向垂直纸面向外的匀强磁场中.若小球由静止开始下滑,且滑行距离L后达到最大速度,求此过程中小球克服摩擦力所做的功.
35(2).(10分)如图所示,质量为m的小球带电量为-q,将它套在一根与水平方向成θ角的足够长的直绝缘杆上,小球与杆间的动摩擦因数为μ,装置处于磁感应强度为B、方向垂直纸面向外的匀强磁场中.若小球由静止开始下滑,且滑行距离L后达到最大速度,求此过程中小球克服摩擦力所做的功.
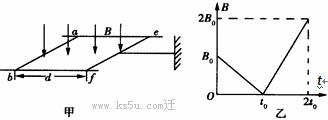
36(16分)、如图(甲)所示,电阻不计、间距为l的平行长直金属导轨固定于水平面内,阻值为R的导体棒ab固定连接在导轨左端,另一阻值也为R的导体棒ef垂直放置在导轨上,ef与导轨接触良好并与导轨无摩擦。现有一根轻杆一端固定于ef中点,另一端固定于墙上。轻杆与导轨保持平行,ef、ab两棒之间距离为d。若整个装置处于方向竖直向下的匀强磁场中,且从某一时刻开始,磁感应强度B随时间t按图(乙)所示的方式变化。试求:
(1)求0→t0时间内流过导体棒ef的电流大小和方向;
(2)求t0 →2t0时间内导体棒ef产生的热量;
(3)写出t0→2t0时间内轻杆对ef 作用力F随时间t 变化的函数关系式,并求出2t0时刻F的大小和方向。
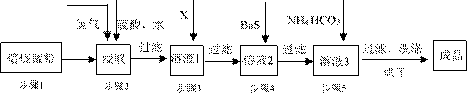
33.(14分)锌锰废电池经处理后,生产并回收硫酸锌及碳酸锰,其中生产工业级碳酸锰工艺如下:
试回答下列问题
(1)锰是第25号元素,它在元素周期表中第_________周期,第_____________族。
(2)步骤1和步骤2是将MnO2等转化为MnO并溶于硫酸,其中步骤2中的氢气,是另一个回收工业流程产生的副产品,请写出产生氢气的化学反应方程式 _________。
(3) 步骤3和步骤4都是除杂质
①X是一种“绿色”氧化剂,则X是____________________________ (填化学式)。
②步骤3是除去杂质Fe2+。请用文字和必要的方程式简述除去Fe2+的方法 (已知三种离子沉淀的pH范围为Fe3+:2.7-3.7,Mn2+:8.6-10.1,Fe2+:7.6-9.6 。)__________________________。
 ③步骤4中主要反应方程式为:MeSO4+BaS=MeS↓+BaSO4↓(Me主要为Pb、Cd、Hg等),则其除去杂质的原理是_______________________________________________。
③步骤4中主要反应方程式为:MeSO4+BaS=MeS↓+BaSO4↓(Me主要为Pb、Cd、Hg等),则其除去杂质的原理是_______________________________________________。
(4) 已知进行步骤5的操作时,溶液3(主要成分为MnSO4)会产生大量无色无味的气泡,则步骤5反应的化学方程式为_______________________________________。
32. (16分)某研究性学习小组的同学对绿矾(FeS04·7H2O)受热分解的情况进行探究。
(16分)某研究性学习小组的同学对绿矾(FeS04·7H2O)受热分解的情况进行探究。
(1)资料表明,在加热条件下SO3具有比较强的氧化性。甲同学认为,绿矾受热分解的产物是FeO、SO3、H2O。你支持该观点吗?说明理由。
_____
(2)乙同学用如图装置通过实验来探究绿矾受热分解的产物情况(加热及夹持装置未画出)。实验过程中发现:装置A中有红棕色固体残留,装置B中无水硫酸铜变蓝,装置C中的U形管中有无色晶体出现。通过查阅资料:SO3的熔点为16.9℃,沸点为45℃。
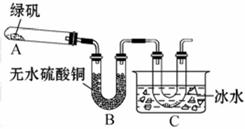
①装置C导管口还应有的实验现象是_______________________________________。
②装置A残留的固体是_________;装置C的U形管中无色晶体是____________。
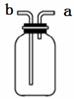 ③为了验证绿矾受热分解的所有产物,在C装置后还须连接一个如右图所示的装置,内装_____________溶液以验证产物______________,连接此装置后仍存在的不足之处是________________________________________。
③为了验证绿矾受热分解的所有产物,在C装置后还须连接一个如右图所示的装置,内装_____________溶液以验证产物______________,连接此装置后仍存在的不足之处是________________________________________。
④为了测定该气体产物的体积,可在右图装置中装满______________,将气体从装置的_______口通入(填“a或b”),并在装置后连上量筒。
⑤写出绿矾受热分解的化学方程式________________________________。
31.(14分)[I] 在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:
2SO2(g)+O2(g) 2SO3(g) ΔH=-92.3KJ/mol
2SO3(g) ΔH=-92.3KJ/mol
反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0-4min时,容器气体压强为0.1MPa):
|
时间min |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
n(SO2) |
2.00 |
1.92 |
1.84 |
1.76 |
1.76 |
1.64 |
1.52 |
1.40 |
1.40 |
1.40 |
|
n(O2) |
1.00 |
0.96 |
0.92 |
0.88 |
0.88 |
0.82 |
0.76 |
0.70 |
0.70 |
0.70 |
|
n(SO3) |
0 |
0.08 |
0.16 |
0.24 |
0.24 |
0.36 |
0.48 |
0.60 |
0.60 |
0.60 |
回答下列问题:
①___________________________时段,反应处于平衡状态。
②第5min时,从同时提高速率和转化率两个方面分析,改变的外界条件是____________________________;平衡向_________________方向移动。
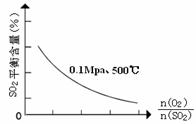 ③在0.1MPa、500℃时,起始时O2和SO2的物质的量之比
③在0.1MPa、500℃时,起始时O2和SO2的物质的量之比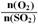 的值,与SO2平衡时的体积百分含量的变化曲线如图。
的值,与SO2平衡时的体积百分含量的变化曲线如图。
在图中画出在相同压强下,温度为400℃时,起始O2和SO2的物质的量之比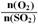 的值,与SO2平衡时的体积百分含量的大致变化曲线。
的值,与SO2平衡时的体积百分含量的大致变化曲线。
[II] (1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系不正确的是________________________
A.c(HA)<c(A-) B.c(HA)一定大于0.1mol/L C.c(Na+)=c(HA)+c(A-)
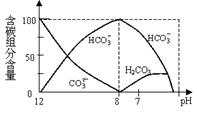 (2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的部分情况如下图所示。
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的部分情况如下图所示。
①在同一溶液中,H2CO3、HCO3-、 CO32-(填:“能” 或“不能”)_______大量共存。
②已知在25℃时,CO32-水解反应的平衡常数即水解
常数Kh=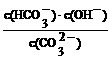 =2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH=___________________________。
=2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH=___________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com