
题目列表(包括答案和解析)
30.[化学-物质结构](13分)
元素A、B、C、D四种元素位于元素周期表的前四周期,A元素原子的2p轨道上有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是本周期元素中电负性最大的,D的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:l。试回答:
(1)A原子的原子结构示意图为___________。
( 2)A、B分别与C形成的化合物的熔点大小顺序为___________(写化学式)。原因是:
(3)A、B的第一电离能的大小顺序为 。
(4)A、B、C、D单质能形成原子晶体的是_____________(写化学式)。
(5)A与C形成的共价化合物a,该分子中的中心原子轨道采用 杂化成键,a分子的立体构型为 。
(6)D元素的名称是 ,D2+离子的核外电子排布式是 。
29.(物理-选修3-5,本题共有两小题,每小题6分,共12分。每小题只有一个选项符合题意。)
(1)、处于基态的氢原子在某单色光束照射下,能发出频率为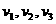 的三种光,且
的三种光,且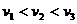 则该照射光的光子能量为 (填选项前的编号)
则该照射光的光子能量为 (填选项前的编号)
①  ②
② ③
③ ④
④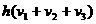
( 2 )、 质量为4.0千克的物体A静止在水平桌面上。另一个质量为2.0千克的物体B以5.0米/秒的水平速度与物体A相撞,碰撞后物体B以1.0米/秒的速度反向弹回。则碰后A的速度为 。(填选项前的编号)
①3 m/s ②-3m/s ③2 m/s ④-2m/s
28.(物理一选修3-3,本题共有两小题,每小题6分,共12分。每小题只有一个选择符合题意。)
(1)夏天,如果自行车内胎充气过足,在阳光下爆晒很容易“爆胎”。“爆胎”前内胎容积视为不变,则下列说法中正确的是____________。(填选项前的编号)
①“爆胎”前随着温度升高,车胎内气体压强将增大
②“爆胎”前随着温度升高,车胎内气体将向外放出热量
③“爆胎”是车胎所有气体分子的动能都急剧增大造成的
④“爆胎”是车胎内气体分子间斥力急剧增大造成的
(2)某同学家一台新电冰箱能显示冷藏室内的温度。存放食物之前,该同学关闭冰箱密封门并给冰箱通电。若大气压为1.0×10
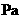 ,刚通电时显示温度为27℃,通电一段时间后显示温度为6℃,则此时冷藏室中气体的压强是______。(填选项前的编号)
,刚通电时显示温度为27℃,通电一段时间后显示温度为6℃,则此时冷藏室中气体的压强是______。(填选项前的编号)
① ②
② ③
③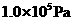 ④
④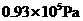
27.(15分)燕麦的颖色受两对等位基因(B-b,Y-y)控制,有黑色B__ __ __,黄色bbY__,白色bbyy三种类型,现有黑颖(甲)和黄颖(乙)两纯合亲本杂交,F1全为黑颖,F1自交后,F2为黑莹;黄颖;白颖=12:3:1。请回答下列问题:
(1)两纯合亲本基因型为:甲__________,乙___________。
(2)请问这两对等位基因是否位于两对同源染色体上?__________,(填“是”或“不是)
并用遗传图解进行解释。
(3)若F1与白颖燕麦杂交,则子代性状及分离比为__________________。
(4)若基因型为BBYY的燕麦具有更强的抗逆性和更高的蛋白质含量,下面是利用甲、乙两亲本培育出此品种的育种方案,请补充完整。 育种过程:
①杂交,得到F1:BbYy(黑颖);
②取F1配子→____________ →单倍体幼苗→秋水仙素处理→纯系植株;
③随机选取黑颖植株并编号,其基因型为BBYY , BByy,选取后,每株的部分种子留存,部分种子种值,并与白颖植株杂交,得F3;
④将F3自交,观察后代性状情况,若后代______________,则原黑颖植株所界种子即为BBYY;否则应淘汰。
说明:第Ⅱ巻选考部分共5题。共35分。其中第28、29题为物理题,第30、31、题为化学题,考生从两道物理题、两道化学题中各任选一题作答,若第28、29题都作答,则按第28题计分,若第30、31题都作答,则按第30题计分;第32题为生物题,是必答题。请将答案写在答题卡上的指定位置上。
26.(25分)回答下列Ⅰ、Ⅱ题:
Ⅰ、(15分)某学习小组用黑藻进行光合作用实验,他们将黑藻浸在加有适宜培养液的6大试管中(室温20℃),可观察到光下黑藻放出气泡。他们以日光灯作光源,移动日光灯使之与大 试管的距离不同,结果如图1中曲线1,请回答:
试管的距离不同,结果如图1中曲线1,请回答:
(1)该实验研究的是 (因素)对光合速率的影响,衡量光合速率的指标是 。
(2)该小组在室温10℃和30℃时分别进行了实验,结果如曲线2和3,D点的限制因素是 。
(3)该小组分离出黑藻中的叶绿体(图2为模式图)在适宜条件下培养,在b上发生的能量转换为 ,由b转移至C的物质主要是 。
|
温度(℃) |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
|
光照下吸收CO2(mg/h) |
1.00 |
1.75 |
2.50 |
3.15 |
3.75 |
3.53 |
3.00 |
|
黑暗中释放CO2(mg/h) |
0.50 |
0.75 |
1.25 |
1.75 |
2.25 |
3.00 |
3.50 |
(4)将黑藻放在特定实验装置内,研究温度对光合作用与呼吸作用的影响(其余的实验条件都是理想的),实验以CO2的吸收量与释放量为指标。实验结果如下表所示:
①在一定范围内该绿色植物呼吸速率随温度升高而升高,其原因是 。
②若在昼夜不停的光照下,则该植物生长的最适宜温度是 ,在35℃时,该植物每小时实际光合作用速率为 。(用CO2吸收量表示)
Ⅱ.(10分)下图为人体血糖平衡调节示意图。请据图回答有关问题:

(1)正常情况下人体血糖降低的主要原因是 。
(2)图示中的调节中枢是 ,胰高血糖素的受体细胞主要是 细胞。
(3)从图示可以看出胰高血糖素与胰岛素在调节血糖平衡上具有拮抗作用,除此之外, 胰高血糖素与肾上腺分泌的 在调节血糖平衡上具有协同作用。
(4)胰高血糖素分泌增加会直接 胰岛素的分泌。
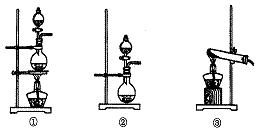
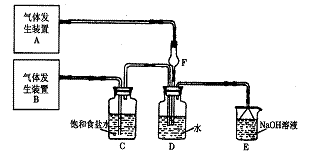
25.(17分)为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。
试填空。
(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的浓硫酸为原料常温下制取SO2,采用MnO2和浓盐酸(12 mol·L-1)为原料制取Cl2。在此实验中,F仪器的作用是: ;发生装置B应选择以上三种装置中的 (选填序号)。
(2)D装置中主要反应的离子方程式为 。
(3)为验证通入D装置中气体是Cl2还是SO2过量,兴趣小组的同学准备了以下试剂:
① 氯化铁溶液 ② 氯化亚铁溶液 ③ 硫氰化钾溶液
④品红溶液 ⑤酸性高锰酸钾溶液
若Cl2过量:取适量D中溶液滴加至盛有 (选填一个序号)试剂的试管内,再加入 (选填一个序号)试剂,发生的现象是: ;
若SO2过量:取适量D中溶液滴加至盛有 (选填一个序号)试剂的试管内,发生的现象是: 。
(4)实验室也可以KMnO4和浓盐酸为反应物来制取Cl2,配平:
KMnO4+ HCl= KCl+ MnCl2+ Cl2↑+ H2O
如果产生89.6L的氯气(标准状况下),则需要转移电子的物质的量为 。
24.(13分)工业合成氨与制备硝酸一般可连续生产,流程如下:


(1)工业生产时,制取氢气的一个反应为:CO+H2O CO2+H2
CO2+H2
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K= 。
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的总转化率α (H2O)= 。
(2)合成塔中发生反应为:N2(g)+3H2(g)
 2NH3(g);△H<0。右表为不同温度下该反应的平衡常数。由此可推知,表中T1
573K(填“>”、“<”或“=”)。
2NH3(g);△H<0。右表为不同温度下该反应的平衡常数。由此可推知,表中T1
573K(填“>”、“<”或“=”)。
|
T/K |
T1 |
573 |
T2 |
|
K |
1.00×107 |
2.45×105 |
1.88×103 |
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
 4NH3+5O2
4NH3+5O2 4NO+6H2O △H=-905kJ·mol-1 不同温度下NO产率如图所示。温度高于900℃时,NO产率下降的原因是
。
4NO+6H2O △H=-905kJ·mol-1 不同温度下NO产率如图所示。温度高于900℃时,NO产率下降的原因是
。
(4)吸收塔中反应为:3NO2+H2O 2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是
。
2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是
。
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:_______ __________________。
23.(15分)有A、B、C、D、E、F、G七种元素,试按下述所给的条件推断:
①A、B、C是同一周期的金属元素,已知原子核外均有3个电子层,A的原子半径在所属周期中最大且原子半径B>C;
②D、E、G是非金属元素,它们都可以跟氢化合生成气态氢化物HD、HE和HG,在室温时,G的单质是黄绿色气体,D的单质是液体,E的单质是固体;
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体;
(1)B位于周期表中第_____ ____周期_____ ___族,。
(2)E的单质颜色是____________________。
(3)A元素与D元素形成化合物的电子式是_______ ___________。
(4)用G单质与消石灰反应制取漂白粉的化学方程式是________________ ________。
(5)F的元素符号是_____________________。
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是_____ ,
酸性最强的化学式是_______________,气态氢化物最稳定的化学式是_____ ____。
(7)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是:______________________ __________。
(8)由B单质与HG反应生成的气体可作某一碱性燃料电池的____ ___极反应物,该电极反应式为 。
22.(20分)如图所示,在真空中坐标xOy面的x>0区域内,有磁感应强度B=0.20T的匀强磁场,方向与xOy平面垂直向里。在x轴上的P(10,0)点处有一放射源,在xOy平面内向各个方向发射速率为v=1.0×106m/s的带正电粒子,粒子的质量为m=6.4×10-27kg,粒子带电量为
q=3.2×10-19C,不计粒子的重力,求:
(1)带电粒子在磁场中运动的轨道半径;
(2)y轴上能被带电粒子击中的最低和最高位置;
(3)打在y轴正向最远点的粒子,在磁场中运动的时间。
21. (19分)个质量为m带电量为+q的小球以水平初速度v0自离地面h高度处做平抛运动.不计空气阻力,开始时空间没有任何的电场或磁场,重力加速度为g,求:
(19分)个质量为m带电量为+q的小球以水平初速度v0自离地面h高度处做平抛运动.不计空气阻力,开始时空间没有任何的电场或磁场,重力加速度为g,求:
(1)小球自抛出点到P点的水平位移x的大小。
(2)若只在空间加一个垂直纸面的匀强磁场,小球恰能沿水平方向做匀速直线运动,求所加的匀强磁场的磁感强度B的大小和方向。
(3)若只在空间加一个沿水平向左方向的匀强电场,小球恰好垂直落在地面上,求小球自抛出点到P点的水平位移x,的大小及所加匀强电场的强度E的大小。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com