
题目列表(包括答案和解析)
6、某集团是一家以生产电缆类产品为主的国家大型企业。在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆)。某化学兴趣小组的四位同学得知这一情况后,围绕“从含铜废料中回收铜”提出了各自的看法。
甲同学根据已学知识,提出了一套回收方案:

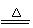 乙同学在查阅资料后得知:在通入空气并加热的条件下,铜可与稀硫酸在溶液中发生反应(方程式为:2Cu + 2H2SO4 + O2 2CuSO4
+ 2H2O),于是他提出了另一套方案:
乙同学在查阅资料后得知:在通入空气并加热的条件下,铜可与稀硫酸在溶液中发生反应(方程式为:2Cu + 2H2SO4 + O2 2CuSO4
+ 2H2O),于是他提出了另一套方案:

(1)甲方案的①②③三个步骤中,与铜或铜的化合物有关的化学反应方程式分别是:
① ;② ;
③ 。
(2)从环保角度对两套方案的不同部分进行比较,你认为 (填“甲”或“乙”)的方案更合理。理由是: 。
(3)丙认为,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑。你认为丙这么说的道理是: 。(2分)
丁又提出了疑问:“如果铁过量,剩余的铁会混在红色粉末中,该怎么处理呢?”。请提出你的想法: 。
(4)最后,老师肯定了同学们的积极思考,但同时指出:方案最后一步所得浅绿色滤液结晶后,会得到一种俗称“绿矾”的工业产品,可增加经济效益。请写出使“绿矾”结晶的两种可能方法: 、 (“绿矾”溶解度随温度升高而增大)。如果直接排放掉滤液,不仅造成了浪费,还会 。
(5)若上述方案所用的稀硫酸溶质质量分数为36.8%,问每1000mL98%的浓硫酸(密度为1.84g/mL)能配制出这种稀硫酸 g,需水 mL(水的密度为1.0g/mL)。在实验室中稀释浓硫酸时,是如何操作的: 。(2分)
 (6)根据乙同学查出的方程式(2Cu + 2H2SO4 + O2 2CuSO4
+ 2H2O)计算:如果1000mL98%的浓硫酸(密度为1.84g/mL)稀释后全部参加了反应(假设硫酸不和碎电缆皮、其他杂质反应),所能处理的废料中含纯铜多少克?(请写出计算过程,结果精确到0.1克。5分)
(6)根据乙同学查出的方程式(2Cu + 2H2SO4 + O2 2CuSO4
+ 2H2O)计算:如果1000mL98%的浓硫酸(密度为1.84g/mL)稀释后全部参加了反应(假设硫酸不和碎电缆皮、其他杂质反应),所能处理的废料中含纯铜多少克?(请写出计算过程,结果精确到0.1克。5分)
5、我校兴趣小组在我市某地收集到两种岩石样品A和B。他们进行了如下实验探究:
(1)写出有关物质的化学式: A的主要成分____________,B的主要成分_____________
X ______________, Y___________
(2)写出图5中下列步骤的化学方程式:
②_________________________⑤ ___________________⑥___________________
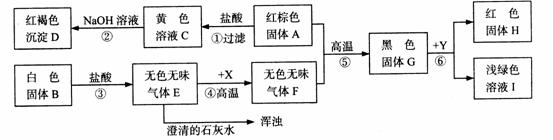
图5
4、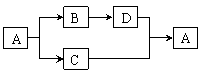 A∽D都是初中化学中的常见物质,且有如图所示转化关系(反应条件、其他反应物及多余产物均已略去)。
A∽D都是初中化学中的常见物质,且有如图所示转化关系(反应条件、其他反应物及多余产物均已略去)。
请写出下列物质的化学式:
A ; B ;C ;D 。
3、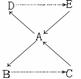 A、B、C、D、E五种物质有如下转换关系,其中D是一种常见的气体,A和E都是盐。D能与C反应生成A,E也能与C反应生成A。
A、B、C、D、E五种物质有如下转换关系,其中D是一种常见的气体,A和E都是盐。D能与C反应生成A,E也能与C反应生成A。
则:A是 ,B是 ,D是 ,
B→C的反应方程式为 。
E和C反应的方程式为 。
2、某学生兴趣小组想利用废铜线制氢氧化铜。他们设计流程图如下:
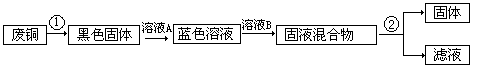
(1) 写出图中编号物质或其溶质的化学式:A_________B_________;
(2) 写出①发生反应的化学方程式____________________________________________;
(3 ) 写出②所用的分离方法:_______________________。
1、某化工厂排放的废水透明、澄清、略带蓝色。一同学取少量废水,加入过量的盐酸,有不溶于稀硝酸的白色沉淀生成。过滤,将所得的滤液分成两份,一份滤液中加入稀硫酸,也有不溶于稀硝酸的白色沉淀生成;另一份滤液中加入氢氧化钠溶液,产生蓝色沉淀。试回答:
(1)加入过量的盐酸,生成的白色沉淀是 ;生成的蓝色沉淀是 。
(2)废水一定含有的物质是 (填编号)
A. 氯化物 B. 硫酸盐 C. 硝酸盐 D. 碳酸盐
(3)该同学设计了一个从废水中除去重金属离子的实验方案如下[已知白色的Fe(OH)2固体在潮湿的空气中可生成红褐色的Fe(OH)3]

①金属X为 ,固体A中一定含有的物质为(写化学式) 。
②B溶液中的溶质一定含有 和 (填序号字母)
A. K2CO3 B. Fe(NO3)2 C. MgCl2 D. Ba(NO3)2
③第IV 步反应的化学方程式为 。
(2)反应后所得溶液中溶质的质量分数是多少?
25.一定质量的稀盐酸与40克质量分数为10%的NaOH溶液反应后所的溶液pH值为7,溶质的质量分数为7.8%,求所用稀盐酸中溶质的质量分数?
20.除去了泥沙的食盐中,还含有对人体健康不利的物质,如氯化钙、氯化镁等,可以用氯化钠饱和溶液反复冲洗来达到精制的目的。这种方法操作简便,不消耗能源,请你简述其中的道理。
19.常温下饱和石灰水升温时,现象是什么?向饱和石灰水中通入一定量的CO2,现象是什么?试解释出现的现象?
18.有A、B、C、D四个烧杯中分别盛有质量相等的同种溶剂,在相同的温度下,向四个小烧杯中分别加入20 g、15 g、10 g、5 g某溶质,充分溶解后,如图所示。请回答:
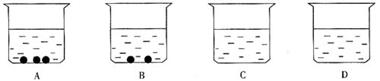
(1) 中盛的一定是饱和溶液; 中盛的可能是饱和溶液; 中盛的一定是不饱和溶液。 (2)四个烧杯的溶液中溶质质量分数是: = ; > ; > ; > 。
(3)若固体溶质是硝酸钾,对A、B两个烧杯同时升高温度(均匀进行),固体物质先消失的是 ;当全部溶质都溶解后溶液中溶质的质量分数比较大的是 。
(4)在一定温度下,在A、B中分别加入相同质量的水,B中固体刚好溶解,A中固体 (填会或者不会)完全溶解?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com