
题目列表(包括答案和解析)
36.(20分)如图所示,电阻忽略不计的、两根平行的光滑金属导轨竖直放置,其上端接一阻值R=3Ω的定值电阻。在水平虚线L1、L2间有一与导轨所在平面垂直的匀强磁场B,磁场区域的高度为d=0.5m。导体杆a的质量ma=0.1kg、电阻Ra=6Ω;导体杆b的质量mb=0.2kg、电阻Rb=3Ω,它们分别从图中M、N处同时由静止开始在导轨上无摩擦向下滑动,且都能匀速穿过磁场区域,当a杆刚穿出磁场时b杆正好进入磁场。设重力加速度为g=10m/s2。(不计a、b之间的作用)求:
(1)在整个过程中,a、b两杆完全穿出磁场区克服安培力分别做的功;
(2)设a、b杆在磁场中的运动速率分别为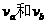 ,则
,则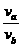 的值为多少?
的值为多少?
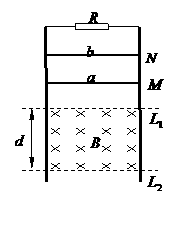 (3)M点和N点距水平虚线L1的高度。
(3)M点和N点距水平虚线L1的高度。
2009~2010学年度广东梅县东山中学高三级理科综合期末考试试题
物 理 答 卷 2010年2月6日
班级___________ 座号___________ 姓名___________ 成绩___________
35.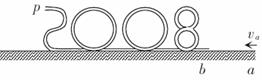 (16分)某兴趣小组设计了如图所示的玩具轨道,其中“2008”四个等高数字用内壁光滑的薄壁圆管弯成,固定在竖直平面内(所有数字均由圆或半圆组成,圆半径比细管的内径大得多),底端与水平面相切。弹射装置将一个小物体(可视为质点)以
(16分)某兴趣小组设计了如图所示的玩具轨道,其中“2008”四个等高数字用内壁光滑的薄壁圆管弯成,固定在竖直平面内(所有数字均由圆或半圆组成,圆半径比细管的内径大得多),底端与水平面相切。弹射装置将一个小物体(可视为质点)以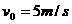 的水平初速度由
的水平初速度由 点弹出,从b点进入轨道,依次经过“8002”后从p点水平抛出。小物体与地面
点弹出,从b点进入轨道,依次经过“8002”后从p点水平抛出。小物体与地面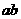 段间的动摩擦因数
段间的动摩擦因数 ,不计其他机械能损失。已知
,不计其他机械能损失。已知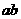 段长
段长 ,数字“0”的半径
,数字“0”的半径 ,小物体的质量
,小物体的质量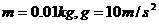 。求:
。求:
(1)小物体运动到b点时的速度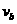 的大小。
的大小。
(2)小物体从p点抛出后的水平射程。
(3)小物体经过数字“0”的最高点时管道对小物体作用力的大小和方向。
34.实验题(本题包含两小题,共18分)
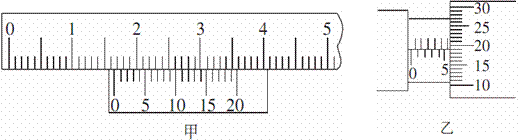
Ⅰ。(8分)(1)读出下面图中游标卡尺与螺旋测微器的示数,游标卡尺的读数为 mm,
螺旋测微器的读数为 mm。
(2)在“研究匀变速直线运动”的实验中,用打点计时器记录纸带运动的时间。计时器所用电源的频率为50Hz,下图为一次实验得到的一条纸带,纸带上每相邻的两计数点之间都有四个点未画出,按时间顺序取0、1、2、3、4、5、6七个计数点,用刻度尺量出1、2、3、4、5、6点到0点的距离分别为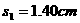 、
、 、
、 、
、 、
、 、
、 。由纸带数据计算可得计数点4所代表的时刻的瞬时速度大小
。由纸带数据计算可得计数点4所代表的时刻的瞬时速度大小
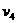 =
m/s,小车的加速度大小
=
m/s,小车的加速度大小 =
=
 。(结果全部保留三位有效数字)
。(结果全部保留三位有效数字)

Ⅱ。(10分)某实验小组要描绘一个标有“3.8V 1W”字样的小灯泡的伏安特性曲线,要求所测电压范围为0V~3.8V。所供选择的器材除了导线和开关外,还有一些器材可供选择:
A、电压表V(量程为5V,内阻约为5kΩ)
B、直流电源E(电动势4.5V,内阻不计)
C、电流表A1(量程为250mA,内阻约为2Ω)
D、电流表A2(量程为500mA,内阻约为1Ω)
E、滑动变阻器R1(阻值范围为0-10Ω)
F、滑动变阻器R2(阻值范围为0-200Ω)
 (1)为了使调节方便,测量的准确度较高,应选用的电流表为 ;应选用的滑动变阻器为 。(填写仪器符号)
(1)为了使调节方便,测量的准确度较高,应选用的电流表为 ;应选用的滑动变阻器为 。(填写仪器符号)
(2)要求实验中小灯泡两端的电压从零逐渐增大到额定电压,测量误差尽可能小。请你为该实验小组设计电路图,并在图中标出器材的符号,画在下面的虚线框中。
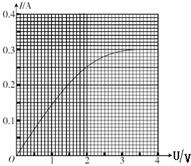 (3)下图中曲线是该学习小组根据实验测得的数据在方格纸上作出的该小灯泡的伏安特性曲线。依据此曲线可求出加在小灯泡上的电压为1V和2V时小灯泡的电阻分别为R1和R2,可见R1 R2(选填“大于”、“等于”或“小于”),导致电阻值有此大小关系的原因是:
(3)下图中曲线是该学习小组根据实验测得的数据在方格纸上作出的该小灯泡的伏安特性曲线。依据此曲线可求出加在小灯泡上的电压为1V和2V时小灯泡的电阻分别为R1和R2,可见R1 R2(选填“大于”、“等于”或“小于”),导致电阻值有此大小关系的原因是:
33.(16分)超音速飞机在平流层飞行时,尾报中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成N2和CO2的化学方程式如下:
2NO+2CO 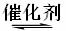 2CO2+N2
2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(CO)/mol·L-1 |
1.00×10-3 |
4.50×10-4 |
2.50×10-4 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
|
c(NO)/
mol·L-1 |
3.60×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
请回答:以下各题(均不考虑温度变化对催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的ΔH 0(填写“>”、“<”、“=”)。
(2)该化学反应平衡常数的表达式K= 。
(3)在此温度下,达平衡时CO的转化率为 。
(4)假设在容器中发生上述反应,达到平衡时下列能提高NO转化率的是
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
①请在空格中填入剩余的实验条件数据。
|
实验编号 |
T/℃ |
NO初始浓度/ mol·L-1 |
CO初始浓度/ mol·L-1 |
催化剂的比表面积/
m2·g-1 |
|
Ⅰ |
280 |
1.20×10-3 |
5.80×10-3 |
82 |
|
Ⅱ |
350 |
|
|
|
|
Ⅲ |
350 |
1.20×10-3 |
5.80×10-3 |
124 |
32.(18分)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
⑴冶炼铜的反应为: 8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
⑵上述冶炼过程产生大量SO2。下列处理方案中合理的是 (填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO4 d.用浓硫酸吸收
⑶过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:
S2O82- + 2I- = 2SO42- + I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。2Fe3++2I-=2Fe2++I2、 (不必配平)
⑷利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+的离子方程式是 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为 。
证明炉渣中含有FeO的实验现象为 。
31.(12分)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
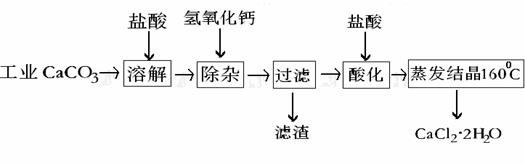
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。
(2)在过滤的实验操作中,如果发现滤液浑浊应如何处理:
(3)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①; ②防止Ca2+在蒸发时水解;③防止溶液吸收空气中的CO2
(4)测定样品中Cl-含量的方法是:
a.称取0.7500 g样品,溶解,在250 mL容量瓶中定容;
b.用移液管量取25.00 mL待测溶液于锥形瓶中;
c.用0.05000 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
① 上述测定过程中需用溶液润洗的仪器有___ __。
② 若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高,其可能原因有 。
A.样品中存在少量的NaCl
B.少量CaCl2·2H2O失水
C.配制标准AgNO3溶液时,烧杯及玻棒末洗涤
D.配制标准AgNO3溶液时,定容俯视
30.(18分)食盐是日常生活的必需品,也是重要的化工原料。
⑴粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为 、NaOH 、 (只填化学式)。
 ②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为
。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为
。
⑵用提纯的NaCl配制500mL4.00 mol·L-1NaCl溶液,所用仪器除药匙、玻璃棒、烧杯、胶头滴管外还有 (填仪器名称)。
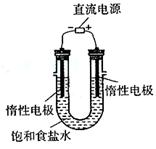
⑶电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2 (填“>”、“=”或“<”)2L,原因是 。装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的实验方法为 。
⑷实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4====ZnSO4+H2↑ 、MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置 (填代号)和制备并收集干燥、纯净Cl2的装置 (填代号)。
可选用制备气体的装置:
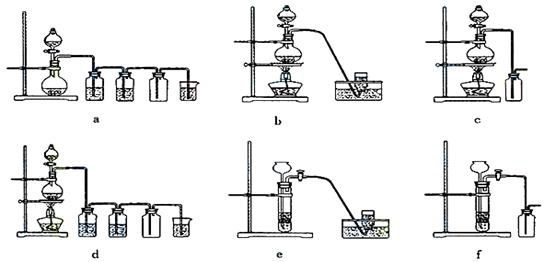
29.(10分,每空1分)反常天气纷现世界各地,凸现严峻的全球气候变暖趋势,其主要原因与碳循环不平衡有关。下图是生态系统中碳循环模式图,据图回答下列问题:

(1)A、B分别为 、 ,①、⑤、⑥三个过程分别是 、
、 。
(2)碳循环在生物群落内部以 形式传递,通过 渠道实现,由于碳循环具有 的特点,联合国制定了《京都议定书》。
(3)某地区进行核试验造成A中出现部分白化苗,则D、C的数量将 。
(4)全球气候变暖的主要原因是 。
28. (20分)回答下列I、II题:
Ⅰ.为了验证某大豆品种的株高与赤霉素的含量有关,请用所给的实验材料,完成下列实验步骤并回答问题:
实验材料:具2片真叶且长势相同的该品种大豆幼苗若干、完全培养液、蒸馏水、适宜浓度的赤霉素溶液、喷壶等。
(1)实验步骤:
①将上述大豆幼苗平均分成A、B两组,A组为对照组,B组为实验组,分别置于等量的完全培养液中培养。
②用喷壶分别将 和 喷洒在A、B两组幼苗上。
③将两组苗置于相同且适宜的温度和光照等条件下培养,一段时间后,测定两组植株的 。
(2)预测实验结果: 。
(3)上述实验中,如果A、B两组各选用1株幼苗进行实验,是否影响实验结果的可靠性?
为什么? 。
(4)该实验原理是:
。
II.在观察洋葱鳞片叶表皮细胞质壁分离和复原现象时发现,蔗糖溶液浓度不适宜会造成实验失败。请据此拟定一个相关研究的课题,要求写出课题名称及相关研究中的自变量和因变量。
课题名称: 。
自变量: 。
因变量: 。
27.(16分)回答下列问题:
(1)水稻杂交育种是通过品种间杂交,创造新变异类型而选育新品种的方法。其特点是将两个纯合亲本的 通过杂交集中在一起,再经过选择和培育获得新品种。
(2)若这两个杂交亲本各具有期望的优点,则杂交后,F1自交能产生多种非亲本类型,其原因是F1在形成配子过程中,位于 基因通过自由组合,或者位于 基因通过非姐妹染色单体交换进行重新组合。
(3)假设杂交涉及到n对相对性状,每对相对性状各受一对等位基因控制,彼此间各自独立遗传。在完全显性的情况下,从理论上讲,F2表现型共有 种,其中纯合基因型共有 种,杂合基因型共有 种。
(4)从F2代起,一般还要进行多代自交和选择。自交的目的是 ;
选择的作用是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com