
题目列表(包括答案和解析)
31.(6分)向34g10%的硝酸银溶液中先加入14g氯化钡溶液,氯化钡完全反应后,把沉淀过滤后除去,然后再向滤液中加入足量氯化钠溶液,完全反应后,将产生的沉淀充分干燥,称得质量为1.435g,求原氯化钡溶液中溶质的质量分数。(保留至0.1%)
30.(4分)某炼铁厂用含20%的赤铁矿石(主要成分是氧化铁)冶炼生铁。求8000kg这种矿石可炼出含铁96%的生铁多少千克?(保留至0.1)
29.(5分)有一包固体混合物,其中可能含有碳酸钙、氯化钠、木炭粉、氧化铜、氧化铁中的一种或几种物质。现进行如下实验:
(1)取少量试样,隔绝空气加热至高温,产生一种能使澄清石灰水变浑浊的气体;
(2)在冷却后的固体残留物上滴加足量稀盐酸,固体残留物部分溶解,生成一种在空气中燃烧时产生淡蓝色火焰的气体,未溶的固体呈红色。
①混合物中肯定含有________________________________。
②为了进一步证明其他物质是否存在,需要进行的实验是(填写实验方法,可能产生的实验现象及由此得出的结论):
|
实验步骤 |
实验现象 |
得出结论 |
|
|
|
|
28.(8分)水是宝贵的自然资源,在工农业生产和日常生活中有着极其广泛的应用。
(1)自来水的生产过程大体如下图:

上图过滤池中有活性炭层,活性炭起 作用,该过程中发生__ ____变化。氯化时,通常通入一定量氯气,它与水反应生成盐酸和次氯酸。实验室配制AgNO3溶液时不宜使用自来水,其原因是(用化学方程式表示)______ 。
(2)电解水时,加入少量NaOH可以增强水的导电性。现将0.1gNaOH溶解在99.9g水里,接通直流电源后,与电源正极相连的一端放出的气体是_________,当溶液中NaOH的质量分数变为0.2%时,有____________水被分解。
 (3)在河旁有甲、乙、丙、丁四座工厂(位置如右图所示),每个工厂排出的废液只含有Na2CO3、FeCl3、NaOH、HCl中的一种。某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清。请回答:
(3)在河旁有甲、乙、丙、丁四座工厂(位置如右图所示),每个工厂排出的废液只含有Na2CO3、FeCl3、NaOH、HCl中的一种。某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清。请回答:
①甲工厂排出的废液是一种碱性物质,检验该物质呈碱性可选用的试剂是_________。
②乙处河水呈红褐色的化学方程式是_____ 。
③丁处产生气泡的化学方程式是____ 。
27.(3分)现有NaOH、BaCl2、Na2CO3三种物质的水溶液,分别将它们依次加入到A、B、C三种无色溶液中,均恰好完全反应(A、B、C互不相同,且不是NaOH、BaCl2、Na2CO3中的任意一种),所得溶液中的溶质是同一种物质。试推断A、B、C可能是哪种物质(写化学式)。A 、B 、C 。
26.(5分)已知A、B、C、D是四种化合物,甲、乙、丙是三种单质:A是含碳合物,A的相对分子质量小于20.在一定条件下,它们之间存在如下转化关系:
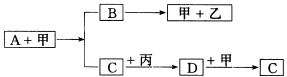
(1)写出A、C、D、甲、乙四种物质的化学式.
A________;C ;D ;甲________;乙_________。
25.(9分)现有下图所示装置(假设酒精灯火焰温度可达到高温)试回答下列问题:

A B C D E F
(1)实验室制取SO2、NH3、H2S四种气体,其原理为:
Na2SO4(固)+H2SO4=Na2SO4+H2O+SO2↑;FeS(固)+H2SO4=FeSO4+H2S↑
Ca(OH)2(固)+2NH4Cl(固) CaCl2+NH3↑+H2O;其中可用A装置作为气体发生装置的气体是
;其中可用B装置作为气体发生装置的气体是
。
CaCl2+NH3↑+H2O;其中可用A装置作为气体发生装置的气体是
;其中可用B装置作为气体发生装置的气体是
。
(2)C装置可以进行多种实验:
①如果通入的CO中含有少量CO2,可将CO2转化为CO,装置中应盛有的物质为 。
②如果通入的CO2中含有少量CO,可将CO转化为CO2,装置中应盛有的物质为 。
③如果通入的CO2中含有少量O2,检验CO2中是否含有O2,装置中应盛有的物质为 。
(3)现用水、生石灰、纯碱为原料制取烧碱,写出有关反应的化学方程式:
; 。则实验时应选用的装置是 。
24. (7分)已知在溶液中氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠。现实验室中有一包白色粉末,可能是碳酸钠,也可能是氧化钙或氢氧化钙。为确定其组成,某同学设计了以下实验方案进行探究,请你按要求帮助完成探究活动。
(7分)已知在溶液中氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠。现实验室中有一包白色粉末,可能是碳酸钠,也可能是氧化钙或氢氧化钙。为确定其组成,某同学设计了以下实验方案进行探究,请你按要求帮助完成探究活动。
(1)提出假设 假设① 白色粉末是碳酸钠 假设② 白色粉末是氧化钙 假设③ 白色粉末是氢氧化钙
(2)设计实验,通过分析进行判断并填空:
|
假设 |
设计相关实验操作 |
实验中观察到的现象 |
假设是否成立 |
|
① |
取一定量粉末加入稀盐酸 |
没有气体产生 |
|
|
② |
取一定量粉末溶于水 |
溶液浑浊且温度升高 |
|
|
③ |
取一定量粉末溶于水,静置后取上层清液通二氧化碳 |
没有沉淀产生 |
|
(3)实验后思考:假定这包白色粉末是混有少量氧化钙的碳酸钠粉末,将混合物溶于水可观察到的现象是 ;若将反应后的混合物进行固液分离,分离的方法是 ;再将分离后的溶液蒸干,得到的固体物质是 (填化学式)。
23. (4分)t℃时,分别向盛有10g水的两支试管中,加入等质量的甲、乙两种固体物质,使其充分溶解,可观察到如右图1所示现象。
(4分)t℃时,分别向盛有10g水的两支试管中,加入等质量的甲、乙两种固体物质,使其充分溶解,可观察到如右图1所示现象。
(1)t℃时 (填“A”或“B”)试管中的溶液一定是饱和溶液。
(2)右图2中可表示是甲物质的溶解度曲线的是 (填“a”或“b”)。要使A试管中剩余的固体继续溶解可采用 或 的方法。
22.(4分)用氧气、稀盐酸、氢氧化铁、高锰酸钾和镁作反应物,写出符合下列四种反应类型的化学方程式:
化合反应 分解反应
置换反应 复分解反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com