
题目列表(包括答案和解析)
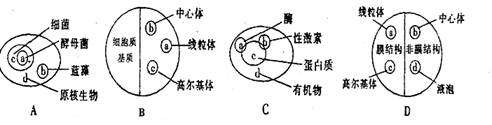
3.下列集合图形中能够比较直观体现概念之间正
确关系的是( )
2. 图示根尖的结构及细胞分裂和分化的情况。相
图示根尖的结构及细胞分裂和分化的情况。相
关叙述正确的是( )
(A)观察细胞质壁分离时可选择a和b区细胞
(B)观察根尖有丝分裂时应选择c区细胞
(C)①过程所经历的时间明显比②过程长
(D)③和④过程中细胞核遗传物质发生了改变
1.下列各项大小(或多少)顺序排列不符合X>Y>Z的是( )
(A)淀粉(X)、麦芽糖(Y)、葡萄糖(Z)分子质量的大小
(B)洋葱表皮细胞短时间浸泡在蒸馏水(X)、0.2mol/L蔗糖溶液(Y)、0.4mol/L蔗糖溶液(Z)中的原生质体的体积大小
(C)玉米的胚(X)、胚乳(Y)、卵细胞(Z)的染色体数
(D)森林生态系统中,生产者(X)、初级消费者(Y)、次级消费者(Z)所同化的能量
10.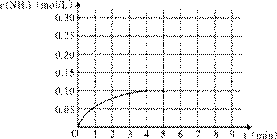 (共16分)在一容积为4 L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:
(共16分)在一容积为4 L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:
N2(g)+3H2(g) 2NH3(g ) △H<0 ,
2NH3(g ) △H<0 ,
反应中NH3的物质的量浓度变化情况如右图:
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(NH3)
为______________mol/(L·min)。
(2)该反应的化学平衡常数表达式K________________________,
随温度的升高,K值将 (填“增大”、“减小”“不变”)
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物
质的量浓度不可能为___________。
a.0.20 mol/L b.0.12 mol/L
c.0.10 mol/L d.0.08 mol/L
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡___________________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数___________(填“增大”、“减小”或“不变”)。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L),请在上图中画出第5分钟末到此平衡时NH3浓度的变化
曲线。
(6)在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,
氨的体积分数随时间变化曲线如下图。下列说法正确的是 (填序号) 。
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下,催化剂性能对反应的影响,且1>2
9.(共16分)某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到沉淀。
甲同学认为两者反应生成只有CuCO3一种沉淀;
乙同学认为这两者相互促进水解反应,生成Cu(OH)2一种沉淀;
丙同学认为生成CuCO3和Cu(OH)2两种沉淀。(已知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.(1)写出Na2CO3溶液水解的离子方程式 ;
(2)在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为
①过滤 ② (填操作名称)③干燥。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。


 (1)各装置连接顺序为
。
(1)各装置连接顺序为
。
(2)装置C中装有试剂的名称是 。
(3)能证明生成物中有CuCO3的实验现象是 。
Ⅲ.若CuCO3和Cu(OH)2两者都有,可通过下列所示装置的连接,进行定量分析来测定其组成。
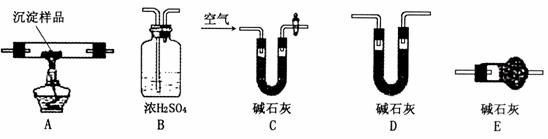
(1)装置C中碱石灰的作用是 ,实验开始时和实验结束时都要通入处理过的过量的空气,其作用分别是: 、 。
(2)若沉淀样品的质量为m g,装置B质量增加了n g,则沉淀中CuCO3的质量分数为:
×100%
8.(共17分)已知有机物A分子由C、H、O三种元素组成,质谱显示A的分子离子峰质荷比
为120,0.1molA在足量的氧气中充分燃烧后生成0.8mol CO2 和7.2g H2O;A可以发生银镜反应,其苯环上的一卤代物有三种。
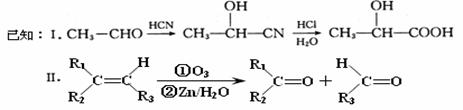 (1)A的分子式是
,A中含氧官能团的名称是
,A的结构简式为
。
(1)A的分子式是
,A中含氧官能团的名称是
,A的结构简式为
。
现有如下转化关系:

其中D能使溴的四氯化碳溶液褪色,F继续被氧化生成G,G的相对分子质量为90。
(2)C可能具有的化学性质有 (填序号)。
① 能与H2发生加成反应
② 能在碱性溶液中发生水解反应
③ 能与甲酸发生酯化反应
④ 能与Ag(NH3) 2OH溶液发生银镜反应 ⑤能与氢氧化钠溶液反应
A.①②③ B.①③⑤ C.①②③⑤ D.②③④⑤
(3) ① 写出C→D的化学反应方程式 ;反应类型为 ;
② 在催化剂条件下,C生成高聚物的化学方程式 ;
③ G与足量NaHCO3溶液反应的化学方程式 。
(4)C的同分异构体有多种,其中符合下列要求的有机物有两种:
①属于酯类化合物
②遇三氯化铁溶液显紫色
③与新制氢氧化铜悬浊液共热可生成红色沉淀
④苯环上的一卤代物只有一种
写出其中一种有机物的结构简式 ,核磁共振氢谱显示该分子中含有 种氢原子。
6.下列说法正确的是 ( )
A.强碱性溶液中,Na+、ClO-、S2-、NO3-能大量共存
B.金属铁吸氧腐蚀的正极反应为:4OH--4 e- = O2↑+ 2H2O
C.在K2S溶液中加入AgCl固体时反应的离子方程式为:2AgCl+ S2- = 2Cl-+ Ag2S↓
 D.已知乙醇和乙烯的燃烧热分别为1366.8 kJ· mol-1和1411.0 kJ· mol-1 ,则乙烯水化制乙醇的热化学方程式为:
D.已知乙醇和乙烯的燃烧热分别为1366.8 kJ· mol-1和1411.0 kJ· mol-1 ,则乙烯水化制乙醇的热化学方程式为:
 ;ΔH = + 44.2 kJ· mol-1
;ΔH = + 44.2 kJ· mol-1
第Ⅱ卷
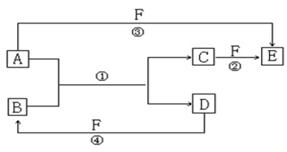
(1)若A、D、F都是短周期的非金属单质,且A、D所含元素同主族,A、F所含元素同周期,已知D单质在电子工业中有重要作用,则D的原子结构示意图为 ;物质E的结构式为 ;反应①的化学方程式为_____________________________。
(2)若A是常见金属单质,D是气态非金属单质,F是液态非金属单质,反应①、②都在溶液中进行,写出A在周期表中的位置 ;用电子式表示B的形成过程 ; 物质C与等物质的量的Cl2在溶液中反应的离子反应方程式为 。
(3)若A、D为常见金属单质,A、D分别与F的浓溶液在加热条件下才能发生反应, 写
出反应④的化学方程式 ;足量的A与溶液B充分反应后,生成物C中金属阳离子的检验方法为 ;若以惰性电极电解B的水溶液,当阴极增重3.2g时,阳极生成气体的体积在标准状况下为 L。
5.现有常温下的四种溶液:
|
溶液编号 |
① |
② |
③ |
④ |
|
溶液名称 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
|
离子浓度 |
pH=11 |
 mol/L mol/L |
 mol/L mol/L |
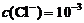 mol/L mol/L |
下列有关叙述正确的是 ( )
A.等体积的四种溶液分别加水稀释10倍后,其pH大小顺序为②>①>④>③
B.将①、④两种溶液按一定体积混合,所得溶液的pH=6,则该溶液中不存在NH3· H2O
C.等体积的①、②两种溶液分别与④完全中和反应时,所需④溶液溶质的物质的量相等
D.在③、④中分别加入少量醋酸钠晶体至常温后溶液的pH均增大,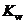 均不变
均不变
4.下列各溶液中,微粒的物质的量浓度关系正确的是 ( )
A.0.1mol/LNaHCO3溶液中:c(H+)+c(H2CO3)= c(CO32-)+c(OH-)
B.将稀氨水逐滴加入稀硫酸中,当溶液呈中性时,c(SO42-)>c(NH4 +)
C.相同温度下,物质的量浓度相同的Ba(OH)2溶液和氨水中c(OH-)之比是2:1
D.常温下,0.1mol/L某一元酸(HA)溶液中c(OH-)/ c(H+)=1×10-8,该溶液中由水电离出的c(H+)=1×10-3 mol·L-1
3.下列有关实验的说法不正确的是 ( )
A.用质谱法可测定有机物的相对分子质量
B.苯酚不慎沾到皮肤上,应立即用酒精洗涤
C.读取滴定管内液体的体积,先平视后俯视导致读数偏小
D.除去乙酸乙酯中的少量乙酸,可以加入乙醇和浓硫酸加热,使乙酸全部转化为乙酸乙酯
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com