
题目列表(包括答案和解析)
2.下列关于原子和原子核的说法正确的是
A. 衰变现象说明电子式原子核的组成部门
衰变现象说明电子式原子核的组成部门
B. 玻尔理论的假设之一是原子能量的量子化
C.放射性元素的半衰期随温度的升高而变短
D.比结合能越小表示原子核中的核子结合得越牢固
1. 下列关于电磁波的说法正确的是
A.均匀变化的磁场能够在空间产生电场 B. 电磁波在真空和介质中传播的速度相同
C. 只要有电场和磁场,就能产生电磁波 D. 电磁波在同种介质中只能沿直线传播
(二)选考题:共45分。请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答,并用2B铅笔在答题卡上把所选题目的题号涂黑。注意所做题目的题号必须与所涂题目的题号一致,在答题卡选答区域指定位置答题。如果多做,则每学科按所做的第一题计分。
33.[物理选修3-3](15分)
 (1)(5分)关于晶体和非晶体,下列说法正确的是B
C(填入正确选项前的字母)
(1)(5分)关于晶体和非晶体,下列说法正确的是B
C(填入正确选项前的字母)
A.金刚石、食盐、玻璃和水晶都晶体
B.晶体的分子(或原子、离子)排列是有规则的
C.单晶体和多晶体有固定的熔点,非晶体没有固定的熔点
D. 单晶体和多晶体原物理性质是各向异性物,非昌体是各向同性的
(2)(10分)如图所示,一开口气缸内盛有密度为ρ的某种液体;一长为l的粗细均匀的小瓶底朝上漂浮在液体中,平衡时小瓶露出液面的部分和进入小瓶中液柱的长度均为l/4。一用活塞将气缸封闭(较中未画出),使活塞缓慢向下运动,各部分气体的渐度均保持不变。发小瓶的底部恰好与液面相平时,进入小瓶中的液柱长度为l/2,求此时气缸内气体的压强。大气压强为ρ0,重力加速度为g。
解:设当小瓶内气体的长度为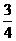 /地,压强为p1;当小瓶的底部恰好与液面相平时,瓶内气体的压强为p2,气缸内气体的压强为p3,依题意 p=p0+
/地,压强为p1;当小瓶的底部恰好与液面相平时,瓶内气体的压强为p2,气缸内气体的压强为p3,依题意 p=p0+ ρgl ①
ρgl ①
由玻意耳定律 p1 S= p2
S= p2 S ②
S ②
式中S为小瓶的横截面积。联立①②两式,得 p2=
 ③
③
又有 p2= p1+ ④ 联立③④ 式,得p1=
④ 联立③④ 式,得p1=
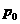 +
+ ⑤
⑤
34.[物理--选修3-4](15分)
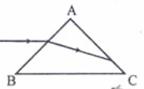 (1)(5分)如图,一个三棱镜的界面为等腰直角△ABC,∠A为直角,此截面所有平面内的光线沿平行于BC边的方向射到AB边,进入棱镜后直接射到AC边上,并刚好能发生全反射。该棱镜材料的折射率为________(填入正确选项前的字母)
(1)(5分)如图,一个三棱镜的界面为等腰直角△ABC,∠A为直角,此截面所有平面内的光线沿平行于BC边的方向射到AB边,进入棱镜后直接射到AC边上,并刚好能发生全反射。该棱镜材料的折射率为________(填入正确选项前的字母)
A. B.
B.
C.  D.
D.
 (2)(10分)波源S1和S2振动方向相同,频率均为4Hz,
(2)(10分)波源S1和S2振动方向相同,频率均为4Hz,
分别置于均匀介质中x轴相向传播。波速为4m/s。已知两
波源振动的初始相位相同。求:
(ⅰ)简谐横波的波长; (ⅱ )OA间合振动振幅最小的点的位置。
解:(ⅰ)设简谐横波波长为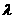 ,频率为
,频率为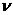 ,波速为v, 则
,波速为v, 则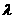 =
=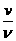 ①
①
代入已知数据得 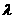 =1m ②
=1m ②
(ii)以O为坐标原点,设P为OA间的任意一点,其坐标为x,则两波源到P的波程差 为
为
其中 为单位。
为单位。
合振动振幅最小的点的位置满足 

35 (物理--------选修)(15分)
(1)(5分)用频率为 的光照射大量处于基态的氢原子,在所发的光谱中仅能观测到频率分别为
的光照射大量处于基态的氢原子,在所发的光谱中仅能观测到频率分别为 的三条谱线,且
的三条谱线,且 则_____B________。(填入正确选项前的字母)
则_____B________。(填入正确选项前的字母)
A  B
B  C
C  D
D 
(2)(10分)如图所示,光滑的水平地面上有一木板质量的2倍,重物与木板间的动摩擦因数为 ,使木板与重物以共同的速度
,使木板与重物以共同的速度 向右运动,某时刻木板与墙发生弹性碰撞,碰撞时间极短,求木板从第一次与强碰撞到再次碰撞所经历的时间。设木板足够长,重物始终在木板上,重力加速度为g。
向右运动,某时刻木板与墙发生弹性碰撞,碰撞时间极短,求木板从第一次与强碰撞到再次碰撞所经历的时间。设木板足够长,重物始终在木板上,重力加速度为g。
解:第一次与墙碰撞后,木板的速度反向,大小不变,此后木板向左做匀减速运动,重物向右做匀减速运动最后木板和重物达到一共同速度 。设木板的质量为m,重物的质量为2m,取向右为动量的正向,由动量守恒得
。设木板的质量为m,重物的质量为2m,取向右为动量的正向,由动量守恒得
设从第一次与墙碰撞到重物和木板具有共同速度 所用的时间为
所用的时间为 ,对木板应用动量定理得
,对木板应用动量定理得
由牛顿第二定律得 2μ mg=ma ③
式中a为木板的加速度。
在达到共同速度v时,木板离墙的距离l为 4
4
开始向右做匀速运动到第二次与墙碰撞的时间为t2=  5
5
从第一次碰撞到第二次碰撞所经过的时间为t=t1+t2 6
由以上各式得 t=  7
7
36.[化学--选修化学与技术](15分)
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。请回答下列问题:
(1)天然水中溶解的气体主要有 O2 、 CO2 .
(2)天然水灾净化处理过程中加入的混凝剂可以是明矾、硫酸铝、硫酸铁、硫酸亚铁 (填其中任何两种)其净水作用的原理是铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体,使其下沉,达到净化目的;
(3)水的净化与软化的区别是水的净化是用混凝剂(如明矾等)将水中胶体及悬浮物沉淀下来,而水的软化是除去水中的钙离子和镁离子;
(4)硬度为1°的水是指每升水含1GmgCaO或与之相当的物质(如7.1mgMgO)。若某天然水中c(Ca2+)=1.2×10-3mol·L-1, c(Mg2+)=6×10-4mol·L-1 则此水的硬度为 10°;
(5)若(4)中的天然水还含有c( )==8×10-4mol·L-1 ,现要软化10m3这种天然水,则需先加入Ca(OH)2
740 g,然后NaCO3 1784 g.
)==8×10-4mol·L-1 ,现要软化10m3这种天然水,则需先加入Ca(OH)2
740 g,然后NaCO3 1784 g.
37、[化学------选修物质结构与性质](15分)
主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍。X、Y和Z分属不同的周期,它们的原子序数之和是W原子序数的5倍。在由元素W、X、Y、Z组成的所有可能的二组分化合物中,由元素W与Y形成的化合物M的熔点最高。请回答下列问题:
(1) W元素原子的L层电子排布式_2s22p4___,W3分子的空间构型为___V形__;
(2) X单质与水发生主要反应的化学方程式为_____2F2+2H2O=4NF+O2_______;
(3) 化合物M的化学式为__MgO_,其晶体结构与NaCl相同,而熔点高于NaCl。M熔点较高的原因是__晶格能大__。将一定量的化合物ZX负载在M上可制的ZX/M催化剂,用于催化碳酸二甲酯与月桂醇交换合成碳酸二月桂酯。在碳酸二甲酯分子中,碳分子采用的杂化方式有__sp3和sp2__,O-C-O的键角为_120o__;
(4) X、Y、Z可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角,Z处于体心位置,则该晶体的组成为X:Y:Z=__3;1:1__;
(5) 含有元素Z的盐的焰色反应为_紫色_。许多金属盐都可以发生焰色反应,其原因是_激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长(可见光区域)光的形式释放能量_。
38、[化学----选修有机化学基础](15分)
PC是一种可降解的聚碳酸酯类高分子材料,由于其具有优良的耐冲击性和韧性,
因而得到了广泛的应用。以下是某研究小组开发的生产PC的合成路线:

已知以下信息:
① A可使臭的 C Cl4 溶液褪色: ② B中有五种不同的化学环境的氢:
③ C可与 FeCl3的溶液发生显色反映:
④ D不能使臭的C Cl4溶液褪色,其核磁共振氢谱为单峰。
请回答下列问题:
(1)A的化学名称是丙烯
(2)B的结构简史为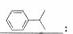
(3)C与D反映生成E的化学方程式为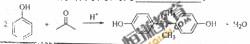
(4)D有很多同分异构体中含有苯环的有 7 种,其中在核磁共振中出现两组峰,且面积之比为3:1的是 (写出结构简式)。
(写出结构简式)。
39.[生物--选修模块1:生物技术实践]
下列是与芳香油提取相关的问题,请回答:
下列是与芳香油提取相关的问题,回答:
(1) 玫瑰精油适合用水蒸气蒸馏法提取。其理由是玫瑰精油具有易挥发、难溶于水、化学性质稳定的性质。蒸馏时收集的蒸馏液不是(是、不是)纯的玫瑰精油,原因是玫瑰精油随水蒸气一起蒸馏出来,所得到的是油水混合物。
(2) 单独蒸馏水瓶中的水和原料量一定时,蒸馏过程中,影响精油提取量的主要原因有蒸馏时间和蒸馏温度。当原料量等其他条件一定时,提取量随蒸馏时间的变化趋势是在一定时间内提取量随蒸馏时间的延长而增加,一定时间后提取量不再增加。
(3) 如果蒸馏过程中不进行冷却,则精油提取量会下降,原因是部分经由会随水蒸气挥发而流失。
(4) 密封不严的瓶装玫瑰精油保存时最好存在温度较低的地方,目的是减少挥发。
(5) 某植物花中精油的相对含量随花的不同生长发育时期的变化趋势如图所示。提取精油是采摘花的最适合时间为a天左右。
(6) 从薄荷叶中提取薄荷油时能(能、不能)采用从玫瑰花中提取玫瑰精油的方法,理由是薄荷油与玫瑰精油的化学性质相同。

40. (生物----选修模块3: 现代生物科技专题)(15分)
请回答:
(1)植物微型繁殖技术属于植物组织培养的范畴。该技术可以保持品种的 遗传特性,繁殖种苗的速度 快。离体的叶肉细胞在适宜的条件下培养,最终能够形成完整的植株,说明该叶肉细胞具有该植物的全部遗传信息。
(2)把试管苗转接到新的培养基上是,需要在超净工作台上进行,其原因是避免微生物的污染。
(3)微型繁殖过程中,适宜浓度的生长素单独使用可诱导试管苗生根,而与细胞分裂素配比适宜时可促进芽的增殖。若要抑制试管苗的生长,促使愈伤组织产生和生长,需要使用的生长调节剂是2,4-D(脱落酸、2,4-D)。
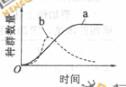
(4)将某植物试管培养在含不同浓度的培养基上一段时间后,单株鲜重和光合作用强度的变化如图。据图分析,随着培养基中蔗糖浓度的增加,光合作用强度的变化趋势是 逐渐减小 ,单株鲜重的变化趋势是 先增加后下降 。椐图判断,培养基中不含蔗糖时,试管苗光合作用产生的有机物的量 _不能__(能、不能)满足自身最佳生长的需要。

(5)据图推测,若要在诱导试管苗生根的过程中提高其光合作用能力,应 _降低_ (降低,增加)培养基中蔗糖浓度,以便提高试管苗的自养能力。
B卷选择题答案
1.C 2. D 3. A 4. A 5. D 6. D 7. C 8. B 9. C 10. D
11.A 12.C 13. B 14.BC 15.C 16.AC 17. A 18. B 19.B 20. D 21.B
(一)必考题(11题,共129分)
22.(4分)
 图为验证机械能量守恒定律的实验装置示意图。现有的器材为:带铁夹的铁架台、电磁打点计时器、带铁夹的重锤、天平。回答下列问题:
图为验证机械能量守恒定律的实验装置示意图。现有的器材为:带铁夹的铁架台、电磁打点计时器、带铁夹的重锤、天平。回答下列问题:
(1)为完成此实验,除了所给的器材,还需要 的器材有AD。(填入正确选项前的字母)
A.米尺 B.秒表
C.0-12V的直流电源 D. 0-12V的交流电源
 (2)实验中误差产生的原因有纸带和打点计时器之间有摩擦;用米尺测量纸带上点的位置时读数有误差。(写出两个原因)
(2)实验中误差产生的原因有纸带和打点计时器之间有摩擦;用米尺测量纸带上点的位置时读数有误差。(写出两个原因)
23.(11分)
用对温度敏感的半导体材料制成的某热敏电阻R1,在给定温度范围内,其阻值随温度的变化是非线性的。某同学将R1和两个适当的固定电阻R1、R2已成图1虚线框内所示的电路,以使该电路的等效电阻R1的阻值随RT所处环境温度的变化近似为线性的,且具有合适的阻值范围。为了验证这个设计,他采用伏安法测量在不同温度下RL的阻值,测量电路如图1所示,图中的电压表内阻很大。RL的测量结果如表1所示。
|
温度t(℃) |
30.0 |
40.0 |
50.0 |
60.0 |
70.0 |
80.0 |
90.0 |
|
Rt阻值(Ω) |
54.3 |
51.5 |
48.3 |
44.7 |
41.4 |
37.9 |
34.7 |
回答下列问题:
 (1)根据图1所示的电路,在图2所示的实物图上连线。连结如图所示。
(1)根据图1所示的电路,在图2所示的实物图上连线。连结如图所示。
(2)为了检验RL与t之近似为线性关系,在坐标纸上作RL-t关系图线。
RL-t关系曲线如图所示。

(3)在某一温度。电路中的电流表、电压表的示数如图3、4所示。电流表的读数为115mA ,电压表的读数为5.00V。此时等效电阻RL的阻值为3.5Ω;热敏电阻所处的温度约为64.0℃。

24.(14分)
短跑名将博尔特在北京奥运会上创造了100m和200m短跑项目的新世界纪录,他的成绩分别是9.69s和19.30s。假定他在100m比赛时从发令到起跑的反应时间是0.15s,起跑后做匀加速运动,达到最大速率后做匀速运动。200m比赛时,反应时间及起跑后加速阶段的加速度和加速时间与100m比赛时相同,但由于弯道和体力等因素的影响,以后的平均速率只有跑100m时最大速度的98%,求:
(1)加速所用时间和达到的最大速度。
(2)起跑后做匀加速运动的加速度。(结果保留两位小数)
解:(1)设加速所用时间为t(以s为单位),匀速运动的速度为v(以m/s为单位),则有
 vt+(9.69―0.15―t)v=100 ①
vt+(9.69―0.15―t)v=100 ①
 vt+(19.30―0.15―t)×0.96v=200 ②
vt+(19.30―0.15―t)×0.96v=200 ②
由①②式得 t=1.29s ③ v=11.24 m/s ④
(2)设加速度大小为a,则 a=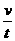 =8.71 m/s2 ⑤
=8.71 m/s2 ⑤
25.(18分)
如图所示,在0≤x≤a、0≤y≤ 范围内有垂直于xy平面向外的匀强磁场,磁感应强度大小为B,坐标原点O处有一个粒子源,在某时刻发射大量质量为m、电荷量为q的带正电粒
范围内有垂直于xy平面向外的匀强磁场,磁感应强度大小为B,坐标原点O处有一个粒子源,在某时刻发射大量质量为m、电荷量为q的带正电粒 子,它们的速度大小相同,速度方向均在xy平面内,与y轴正方向的夹角分布在0-90°范围内,已知粒子在磁场中做圆周运动的半径介于a/2到a之间,从发射粒子到粒子全部离开磁场经历的时间恰好为粒子在磁场中做圆周运动周期的四分之一,求最后离开磁场的粒子从粒子源射出时的
子,它们的速度大小相同,速度方向均在xy平面内,与y轴正方向的夹角分布在0-90°范围内,已知粒子在磁场中做圆周运动的半径介于a/2到a之间,从发射粒子到粒子全部离开磁场经历的时间恰好为粒子在磁场中做圆周运动周期的四分之一,求最后离开磁场的粒子从粒子源射出时的
(1)速度的大小; (2)速度方向与y轴正方向夹角的正弦.
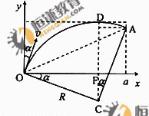 解:(1) 设粒子的发射速度为v,粒子做圆周运动的轨道半径为R,由牛顿第二定律和洛仑兹力公式,得 qvB=m
解:(1) 设粒子的发射速度为v,粒子做圆周运动的轨道半径为R,由牛顿第二定律和洛仑兹力公式,得 qvB=m ①
①
由①式得 R= ②
②
当a/2<R<a时,在磁场中运动时间最长的粒子,其轨迹是圆心为C的圆弧,圆弧与磁场的上边界相切,如图所示.设该粒子在磁场运动的时间为t,依题意t=T/4,得
∠OCA= ③
③
设最后离开磁场的粒子的发射方向与y轴正方向的夹角为α,由几何关系可得
Rsinα=R- ④ Rsinα=α-Rcosα ⑤
④ Rsinα=α-Rcosα ⑤
又 sin2α+cos2α=1 ⑥
由④⑤⑥式得
R= ⑦
⑦
由②⑦式得 v=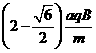 ⑧
⑧
(2)由④⑦式得 sinα= ⑨
⑨
26.(14分)
物质A-G有下图所示转化关系(部分反应物、生成物没有列出).其中A为某金属矿的主要成分,经过一系列反应可得到B和C,单质C可与E的浓溶液发生反应,G为砖红色沉淀.
请回答下列问题:
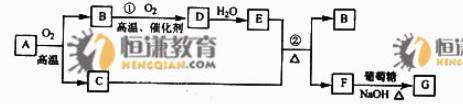
(1)写出下列物质的化学式:B SO2 、E H2SO4 、G Cu2O ;
(2)利用电解可提纯C物质,在该电解反应中阳极物质是 粗铜 ,阴极物质是 精铜 ,电解质溶液是 CuSO4溶液 ;
(3)反应②的化学方程式是Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(4)将0.23 mol B和0.11 mol氧气放入容积为1 L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12 mol D.则反应的平衡常数K=23.8 mol-1L。若温度不变,再加入0.50 mol氧气后重新达到平衡,则B的平衡浓度减小。(填“填大”、“不变”或“减小”),氧气的转化率降低(填“升高”、“不变”或“降低”),D的体积分数减小(填“增大”、“不变”或“减小”)。
27.(15分)
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。请回答下列问题:

(1)装置A中盛放亚硫酸钠的仪器名称是蒸馏烧瓶,其中发生反应的化学方程式为Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
(2)实验过程中,装置B、C中发生的现象分别是溶液由紫红色变为无色、无色溶液中出现黄色浑浊,这些现象分别说明SO2具有的性质是还原性和氧化性;装置B中发生反应的离子方程式为5SO2+2MnO +2H2O=2Mn2++5SO
+2H2O=2Mn2++5SO +4H+;
+4H+;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复为红色;
(4)尾气可采用NaOH溶液吸收。
28.(14分)
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有
Zn+CuSO4=ZnSO4+Cu Zn+H2SO4=ZnSO4+H2↑;
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu/Zn微电池,加快了氢气产生的速率;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是Ag2SO4;
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的比表面积等(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体。记录获得相同体积的气体所需时间。
 实验
实验混合溶液 |
A |
B |
C |
D |
E |
F |
|
4
mol·L-1 H2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
|
饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
|
H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5;
②反应一段时间后,实验A的金属是呈灰黑色,实验E中的金属呈暗红色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因。加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积.
29.(9分)
将同种大鼠分为A、B两组,A组大鼠除去淋巴细胞后,产生体的能力丧失;从B组大鼠中获得淋巴细胞并转移到A组大鼠后,发现A组大鼠能够重新获得产生沉体的能力。请回答:
(1)上述实验可以说明淋巴细胞(B淋巴细胞)是免疫反应所需的细胞。
(2)为了证明接受了淋巴细胞的A组大鼠重新获得了产生抗体的能力,需要给A大鼠注射抗原,然后检测相应的抗体
(3)动物体内能产生特异性抗体的细胞称为细胞(或效应B淋巴细胞)。
在抗体、溶菌酶、淋巴因子和编码抗体的基因四种物质中不属于免疫活性物质的是编码抗体的基因。在吞噬细胞、淋巴细胞和红细胞这三类细胞中不属于免疫细胞的是红细胞.
30.(9分)
 从某植物长势一致的黄化苗上切取等长幼等段(无叶和侧芽),将茎段自顶端向下对称纵切至的3/4处后,浸没在不同浓度的生长素溶液中,一般时间后,茎段的半边茎会向切西侧弯曲生长形成弯曲角度(a)如图甲,a与生长素浓度的关系如图乙。请回答:
从某植物长势一致的黄化苗上切取等长幼等段(无叶和侧芽),将茎段自顶端向下对称纵切至的3/4处后,浸没在不同浓度的生长素溶液中,一般时间后,茎段的半边茎会向切西侧弯曲生长形成弯曲角度(a)如图甲,a与生长素浓度的关系如图乙。请回答:
(1)从图乙可知,在两个不同浓度的生长素溶液中,茎段半边茎生长产生的弯曲角度可以相同,请根据生长素作用的特征。解释产生这种结果的原因,原因是生长素的生理作用具有双重性,最适生长素浓度产生最大a值,高于最适浓度时有能出现与低于最适浓度相同的弯曲生长,从而产生相同的a。
(2)将切割后的茎段浸没在一未知浓度的生长素溶液中,测得其半边茎的弯曲角度a1,从图乙中可查到与a1对应的两个生长素浓度、即低浓度(A)和高浓度(B)。为进一步确定待测溶液中生长素的真实浓度,有人将待测溶液稀释至原浓度的80%,另取切割后的茎段浸没在其中,一段时间后测得半边的弯曲角度将得到a2。请预测a2与a1相比较的可能结果并得出相应的结论:若a2小于a1,则该溶液的生长浓度为A:若a2大于a1,则该溶液的生长素浓度为B。
31.(8分)
 假设a、b、c、d是一个简单生态系统中最初仅有的四个种群其a、c、d的营养关系为a→c→d,a与b的关系如图,a是该生态系统主要的自养生物,请回答:
假设a、b、c、d是一个简单生态系统中最初仅有的四个种群其a、c、d的营养关系为a→c→d,a与b的关系如图,a是该生态系统主要的自养生物,请回答:
(1)该生态系统中a和b的种间关系是竞争
(2)若d大量死亡,则一定时间内种群密度增加的种群是 c ,种群密度减少的种群是
a 。
(3)若持续干旱使a大量死亡,c和d种群密度将会降低。
(4)当受到外界的轻微干扰后,经过一段时间,该生态系统可以恢复到原来的状态,说明该系统具有恢复力稳定性。与热带雨林相比,该生态系统的抵抗力稳定性低(低、高)。
(5)为了调查该系统c种群的密度,捕获了50个个体,将这些个体标记后放掉,
一段时间后重新捕获了40个个体,其中有5个带有标记,c种群的数量约为400个。
32.(13分)
某种自花受分植物的花色分为白色、红色和紫色。现有4个纯含品种:1个紫色(紫)、1个红色(红)、2个白色(白甲和白乙)。用这4个品种做杂交实验,结果如下:
实验1:紫×红,F1表现为紫,F2表现为3紫:1红;
实验2:红×白甲,F1表现为紫,F2表现为9紫:3红:4白;
实验3:白甲×白乙,F1表现为白,F2表现为白;
上述实验结果,请回答:
(1)上述花色遗传所遵循的遗传定律是自由组合定律。
(2)写出实验1(紫×红)的遗传图解(若花色由一对等位基因控制,用A、a表示,若由两对等位基因控制,用A、a和B、b表示,以此类推)。遗传图解为

(3)为了验证花色遗传的特点,可将实验2(红×白甲)得到的F2植株自交,单收获F2中紫花植株所结的种子,每株的所有种子单独种植在一起可得到一个株系,观察多个这样的株系,则理论上,在所有株系中有4/9的株系F3花色的表现型及其数量化为9紫:3红:4白。
14.在电磁学发展过程中,许多科学ia作出了贡献,下列说法正确的是 [A]
A.奥斯特发现了电流磁效应;法拉第发现了电磁感应现象
B.麦克斯韦预言了地磁波;楞次用实验证实了地磁波的存在
C.昆仑发现了点电荷的相互作用规律;密立根发现了磁场对电流的作用规律
D.安培发现了磁场对运动电荷的作用规律;洛仑兹发现了磁场对电流的作用规律
15.一根轻质弹簧一端固定,用大小为F1的力压弹簧的另一端,平衡的长度为l1;改用大小为F2的力拉弹簧;平衡的长度为l2。弹簧的拉伸或压缩均在弹性限度内,该弹簧的劲度系数为 [C]
A.  B.
B.  C.
C.  D.
D. 
16.如图所示,在外力作用下某质点运动的v-t图像为正泫曲线。从图像可以判断[A、D]

A.在0~t1时间内,外力作正功
B. 在 0~t1时间内外力的功率逐渐增大
C.在 t2时刻,外力的功率最大
D.在t1~t3时间内,外力做的总功为零
17. 静电除尘器是目前普遍采用的一种高效除尘去。某除尘器模型的收衬板是很长的条形金属板,图中直线a、b为该收尘器的横截面。工作时收尘器带正电,其左侧的电场分布如图所示,粉尘带负电,在电场作用下向收尘版运动,左后落在收尘版上。若用粗黑曲线表示原来静止与点P的带电粉尘颗粒的运动轨迹,下列4附图中可能正确的是(葫芦哦重力和空气阻力) [A]
静电除尘器是目前普遍采用的一种高效除尘去。某除尘器模型的收衬板是很长的条形金属板,图中直线a、b为该收尘器的横截面。工作时收尘器带正电,其左侧的电场分布如图所示,粉尘带负电,在电场作用下向收尘版运动,左后落在收尘版上。若用粗黑曲线表示原来静止与点P的带电粉尘颗粒的运动轨迹,下列4附图中可能正确的是(葫芦哦重力和空气阻力) [A]

18. 如图所示,一物体置于水平地面上。当用水平方向成60°角的力F1时,物体做直线运动:当改用与水平方向成30°角的力F2拉物体时,物体仍做匀速直线运动。若F1 和F2的大小相等,则物体与地面的之间的摩擦因数为[B]
如图所示,一物体置于水平地面上。当用水平方向成60°角的力F1时,物体做直线运动:当改用与水平方向成30°角的力F2拉物体时,物体仍做匀速直线运动。若F1 和F2的大小相等,则物体与地面的之间的摩擦因数为[B]

19.电源的效率η 定义为外电路电阻消耗的功率与电源的总功率之比。在测电源电动势和内电阻的实验中得到的实验图线如图所示,图中U为路端电压,I为干路电流,a,b为图线上的两点,相应状态下电源的功率分别为ηa, ηb由图可知ηa, ηb值分别为[D]


20.太阳系中的8大行星的轨道均可以通过可以近似看做圆轨道。下列4幅图是用来描述这些行星运动所遵从的某一规律的图像。图中坐标系的横轴是lg (T/T0) ,纵轴是lg(R/R0);这里T和R分别是行星绕太阳运行周期和相应的圆轨道半径,T0和R0 分别是水星绕太阳运行的周期和相应的圆轨道半径。下列4幅图中正确的是[B]

21. 如图所示,两个端面半径为R的圆柱形铁芯同轴水平放置,相对端面之间有一缝隙,铁芯绕上导线并与电源连接,在缝隙中形成一均匀磁场。一铜质细直棒ab水平放置于缝隙中,且与圆柱轴线等高、垂直。让铜棒从静止开始自由下落,,铜棒下落距离为0.2R时铜棒中电动势能大小为E1.,下落距离为0.8R时电动势能为E2。忽略涡流损耗和边缘效应。关于E1、E2的大小和铜棒离开磁场前两端的极性,下列判断正确的是[D]
如图所示,两个端面半径为R的圆柱形铁芯同轴水平放置,相对端面之间有一缝隙,铁芯绕上导线并与电源连接,在缝隙中形成一均匀磁场。一铜质细直棒ab水平放置于缝隙中,且与圆柱轴线等高、垂直。让铜棒从静止开始自由下落,,铜棒下落距离为0.2R时铜棒中电动势能大小为E1.,下落距离为0.8R时电动势能为E2。忽略涡流损耗和边缘效应。关于E1、E2的大小和铜棒离开磁场前两端的极性,下列判断正确的是[D]
A. E1.>E2 ,a端为正 B. E1.>E2 ,b端为正
C. E1.<E2 ,a端为正 D. E1.<E2 ,b端为正
13.下表中评价合理的是

12.根据右图,可判断出下列离子方程式中错误的是 (A)
A.2Ag(s) + Cd2+(s) = 2Ag(s) + Cd(s)
B. Co2+(aq)+ Cd(s) = Co(s)+ Cd2+(aq)
C. 2Ag (aq) + Cd(s) = 2Ag(s) Cd2+(aq)
D. 2Ag (aq) +Co(s)=2Ag(s)+Co2+(aq)

11.已知:HCN(aq)与NaOH(aq)反应的△H等于 [C]
A.-67.7KJ·mol·L-1
B.-43.5 KJ·mol·L-1
C.+43.5 KJ·mol·L-1
D.+67.7 KJ·mol·L-1
10.把500ml含有BaCl2和KCl的混合溶液分成5等分,取一份加入含a mol硫酸钠的溶液,恰好是钡离子完全沉淀:令取一份加入b mol硝酸银的溶液,恰好使卤离子完全沉淀,则该混合溶液中钾离子浓度为 [D]
A.0.1(b-2a)mol·L-1
B.10(2a-b) mol·L-1
C.10(b-a) mol·L-1
D.10(b-2a) mol·L-1
9.下列各组的反应,属于统一反应类型的是 [D]
A.由溴丙烷睡解制丙醇:由丙烯和水反应制丙醇
B.由甲苯硝化制对硝基甲苯:由甲苯氧化制苯甲酸
C.由苯乙烷消去制环乙烯:由丙烯加溴制1,2-二溴丙烷
D.由乙酸和乙醇制乙酸乙酯:由苯甲酸乙酯水解制苯甲酸和乙醇
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com