
题目列表(包括答案和解析)
4.某同学用青菜的幼苗进行了四项实验,如图所示。下列说法不正确的是
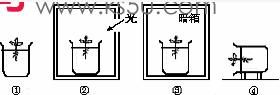 A.实验②③对照可以证明植物生具有向光性
A.实验②③对照可以证明植物生具有向光性
B.实验③进行一段时间后,青菜叶片发黄的原
因是无光条件叶绿素不能合成
C.实验④的生长结果只能证明根的生长具有向地性
D.实验①的目的是对实验②③④起对照作用
3.下列关于生物与环境的关系叙述正确的是 ( )
A.狐吃了一只兔,狐获得了兔的全部能量
B.影响神农架植物垂直分布的主要非生物因素是阳光
C.云南山苍子的柠檬酸含量高于浙江的山苍子,这是昼夜温差对其柠檬酸含量的影响
D.当草食动物从天然草场的生态系统转移离开后,将看到的现象是植物竞争强度降低
2.下列有关氮循环中进行固氮作用、氨化作用、硝化作用、反硝化作用的微生物在生态系统中的地位叙述正确的是 ( )
A.全是分解者 B.只有分解者和生产者
C.只有分解者和消费者 D.既有生产者,又有消费者和分解者
1.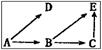 如图所示的是一个生态系统的营养结构,若A包含五个种群(A1、A2、A3、A4、A5),B包含两个种群(B1、B2),则其营养结构实际含有食物链
如图所示的是一个生态系统的营养结构,若A包含五个种群(A1、A2、A3、A4、A5),B包含两个种群(B1、B2),则其营养结构实际含有食物链
A.10条 B.15条
C.20条 D.25条
36.(18分)如图所示,电阻不计的平行金属导轨MN和OP放置在水平面内。MO间接有阻值为R=3Ω的电阻.导轨相距d=lm,其间有竖直向下的匀强磁场,磁感强度B=0.5T。质量为m=0.1kg,电阻为r=lΩ的导体棒CD垂直于导轨放置,并接触良好,现用平行于 MN的恒力F=1N向右拉动CD,CD受摩擦阻力f恒为0.5N。求:
(1)CD运动的最大速度是多少?
(2)当CD达到最大速度后,电阻R消耗的电功率是多少?
 (3)当CD的速度为最大速度的一半时,CD的加速度是多少?
(3)当CD的速度为最大速度的一半时,CD的加速度是多少?
35. (18分)如图,abc是光滑的轨道,其中ab是水平的,bc为与ab相切的位于竖直平面内的半圆,半径R=0.30 m。质量m=0.20 kg的小球A静止在轨道上,另一质量M=0.60 kg、速度
(18分)如图,abc是光滑的轨道,其中ab是水平的,bc为与ab相切的位于竖直平面内的半圆,半径R=0.30 m。质量m=0.20 kg的小球A静止在轨道上,另一质量M=0.60 kg、速度 =5.5 m/s的小球B与小球A正碰。已知相碰后小球A经过半圆的最高点c落到轨道上距b点为
=5.5 m/s的小球B与小球A正碰。已知相碰后小球A经过半圆的最高点c落到轨道上距b点为 处,重力加速度g=10m/s2,求:
处,重力加速度g=10m/s2,求:
(1)碰撞结束时,小球A和B的速度的大小。
(2)试论证小球B是否能沿着半圆轨道到达c点。
34. (1)(8分)利用如图装置做探索弹力和弹簧伸长的关系的实验.所用
(1)(8分)利用如图装置做探索弹力和弹簧伸长的关系的实验.所用
的钩码每只的质量30g。实验中,先测出不挂钩码时弹簧的自然长度,再
将5个钩码逐个加挂在弹簧下端,稳定后测出相应的弹簧总长度,将数据
填在表中.(弹力始终未超过弹性限度,取g=9.8m/s2)
①表记录数据中有一个不合规范,它是第___组中的数据______,应记作
___________。
②在坐标纸中作出弹簧弹力大小F跟弹簧总长度L之间的函数关系的图线,并回答
图线不过原点的原因 。

|
记录数据组 |
1 |
2 |
3 |
4 |
5 |
6 |
|
钩码总质(g) |
0 |
30 |
60 |
90 |
120 |
150 |
|
弹簧总长(cm) |
6.00 |
7.11 |
8.2 |
9.31 |
10.40 |
11.52 |
|
弹力大小(N) |
0 |
0.294 |
0.558 |
0.882 |
11.8 |
14.7 |
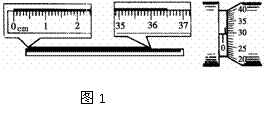
(2)(10分)在“测定金属的电阻率”的实验中,需要用刻度尺测出被测金属丝的长度l,用螺旋测微器测出金属丝的直径d,用电流表和电压表测出金属丝的电阻Rx 。
①请写出测金属丝电阻率的表达式: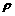 =_____________(用上述测量量的字母表示).
=_____________(用上述测量量的字母表示).
②若实验中测量:金属丝的长度和直径时,刻度尺和螺旋测微器的示数分别如图1所示,则金属丝长度的测量值为l=_________________cm?,金属丝直径的测量值为d=_________________mm.
③用电流表和电压表测金属丝的电阻时,由于电压表、电流表内阻的影响,不论使用电流表内接法还是电流表外接法,都会产生系统误差.按如图2所示的电路进行测量,可以消除由于电表内阻造成的系统误差.利用该电路进行实验的主要操作过程是:
第一步:先将R2的滑动头调到最左端,单刀双掷开关S2向1闭合,闭合电键S1,调节变阻器R1和R2,使电压表和电流表的示数尽量大些(不超过量程),读出此时电压表和电流表的示数U1、I1.
第二步:保持两滑动变阻器的滑动头位置不变,将单刀双掷开关S2向2闭合,读出此时电压表和电流表的示数U2、I2.
请写出由以上记录数据计算被测电阻Rx的表达式Rx=__________________.

33.(16分))将Na2CO3和H2O2混合(Na2CO3和H2O2不发生反应)可用作新型洗涤剂,某化学小组对这种新型洗涤剂进行探究。为定性探究该新型洗涤剂加入FeCl3固体产生气体的成分:
取该洗涤剂100 ml,加入25 gFeCl3固体,产生大量无色无味气体,用贮气瓶收集气体。请利用实验室常用仪器、用品和以下限选试剂完成该气体成分的探究过程。
限选试剂:0.10 mol·L-1 NaOH溶液、8.0 mol·L-1 NaOH溶液、澄清石灰水、0.01 mol·L-1KMnO4溶液、0.1 mol·L-1KI溶液、BaCl2稀溶液、品红溶液、蒸馏水。
(1)对该气体成分提出合理假设
假设1:该气体是O2;假设2:该气体是 ;假设3:该气体是 ;
(2)设计实验方案证明你的假设,在答题卡上按下表的格式完成实验步骤、预期现象与结论:
|
实验步骤 |
预期现象与结论 |
|
将气体依次通入盛有
、
的洗气瓶中,
。 |
若
,则假设1成立; 若 ,则假设2成立; 若 ,则假设3成立。 |
32.(16分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:

已知:① 2KOH + Cl2 = KCl + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 = 5KCl + KClO3 + 3H2O(条件:温度较高)
③ Fe(NO3)3 + KClO + KOH → K2FeO4 +KNO3 + KCl + H2O(未配平)
回答下列问题:
⑴ 该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行。
⑵ 请配平反应③:
Fe(NO3)3 + KClO + KOH → K2FeO4 + KNO3 + KCl + H2O
⑶ 配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47
g / mL),它的物质的量浓度为 。
⑷ 在“反应液I”中加KOH固体的目的是 (填字母)。
A. 与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B. KOH固体溶解时会放出较多的热量,有利于提高反应速率
C. 为下一步反应提供反应物
D. 使副产物KClO3转化为 KClO
⑸ 从“反应液II”中分离出K2FeO4后,会有副产品 (写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途 。
31.(16分)(1)合成氨工业对化学工业和国防工业具有重要意义。

工业合成氨的原理是: △H <0,
生产流程如右图所示。
①X的化学式为
②右图中条件选定的主要原因是(选填字母序号)
A、升高温度、增大压强均有利于氨的合成
B、铁触媒在该温度时活性大
C、工业生产受动力、材料、设备等条件的限制
 ③改变反应条件,会使平衡发生移动。右图表示随条件改变,氨 气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号)
,当横坐标为温度时,变化趋势正确的是(选填字母序号) 。
③改变反应条件,会使平衡发生移动。右图表示随条件改变,氨 气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号)
,当横坐标为温度时,变化趋势正确的是(选填字母序号) 。
(2)常温下氨气极易溶于水,其水溶液可以导电。
④ 用方程式表示氨气溶于水且显弱碱性的过程:
;
⑤ 氨水中水电离出的c(OH-) 10-7 mol·L-1(填写“>”、“<”或“=”)
⑥ 将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到小
依次为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com