
题目列表(包括答案和解析)
13.有关①100 mL 0.1 mol/L NaHCO3 ②100 mL 0.1 mol/L Na2CO3两种溶液的叙述不正确的是( )
A.溶液中水电离出的H+个数:②>①
B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中: c(CO2-3 )>c(H2CO3)
D.②溶液中: c(HCO-3)>c(H2CO3)
12.已知,Fe2+结合S2-的能力大于结合OH-的能力,而Al3+则正好相反。在Fe2(SO4)3和AlCl3的混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是( )
A.Al2S3、FeS和S B.Fe(OH)3和Al(OH)3
C.Fe2S3和 Al(OH)3 D. FeS、Al(OH)3和S
11.比较氯元素和硫元素的非金属性的相对强弱,下列方案中不能达到目的的是( )
A.加热条件下,氯气和硫分别与铜反应,比较生成物中铜的化合价
B.比较氯化氢和硫化氢的热稳定性
C.往H2S溶液中通入氯气
D.分别测定0.1 mol/L氯化钠溶液和0.1 mol/L硫化钠溶液的pH
10.在高温和催化剂存在下,向容积为2 L的密闭容器加入0.2 mol CO和0.2 mol H2O,发生如下反应:CO(g)+H2O(g)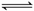 CO2(g)+H2(g);∆H=-a kJ/mol(a>0)。达到平衡后,测得c(CO)∶c(CO2)=2∶3。下列说法正确的是( )
CO2(g)+H2(g);∆H=-a kJ/mol(a>0)。达到平衡后,测得c(CO)∶c(CO2)=2∶3。下列说法正确的是( )
A.反应放出的热量为0.2a kJ
B.平衡时H2O的转化率为60 %
 C.升高温度,v(正) 加快v (逆) 减慢,平衡正向移动
C.升高温度,v(正) 加快v (逆) 减慢,平衡正向移动
D.将容器的体积压缩为1 L,H2的体积分数变为60 %
9.向体积Va的0.05 mol•L −1 NH3•H2O溶液中加入体积为Vb的0.05 mol•L −1 HCl溶液,下列错误的是( )
A.Va>Vb时:c(NH3•H2O) +c( NH+4)>c(Cl-)
B.Va=Vb时:c(NH3•H2O)+ c(OH-)=c(H+)
C.Va<Vb时:c(NH+4)>c(Cl-)>c(H+)>c(OH-)
D.Va与Vb任意比时:c(NH+4) + c(H+)=c(OH-)+ c(Cl-)
8.下列说法中不正确的是 ( )
A.将纯水加热至较高温度,水的离子积变大,pH变小,呈中性
B.25 ℃时,0.1 mol•L −1氨水和0.05 mol•L −1氨水中c(OH-)之比是2∶1
C.相同温度下,pH=2的醋酸溶液与pH=2的盐酸中c(H+)之比为1:l
D.向盛有少量Mg(OH)2沉淀的试管中加入NH4Cl浓溶液,振荡,沉淀会逐渐溶解
7.下列叙述中正确的是( )
A.同一主族元素的气态氢化物,其相对分子质量越大,对应的熔、沸点一定越高
B.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的pH:NaA<NaB
C.若R2-离子和M+离子的电子层结构相同,则原子序数:R>M
D.升高温度可加快反应速率,其主要原因是反应物分子能量增加,单位体积活化分子的数目增多,活化分子的百分数不变,使得有效碰撞次数增多
6.用NA表示阿伏加德罗常数。下列说法正确的是( )
A.标准状况下,22.4 L己烷中共价键数目为19NA
B.1 L 1 mol/L FeCl3溶液中含有NA个Fe3+
C.由CO2和O2组成的混合物中共有NA个分子,其中氧原子数为2NA
D.足量C12与5.6 g Fe完全反应时,转移的电子数为0.2NA
5.圆褐固氮菌所固定的氮素参与氮循环的全过程,下列表述正确的是 ( )
A.N2→NH3→NO3-→生物体有机氮→NH3→NO3-→N2
B.N2→NH3→生物体有机氮→NH3→NO3-→N2
C.N2→NH3→生物体有机氮→NO3-→N2
D.N2→NH3→NO3-→生物体有机氮→NH3→N2
4.下列关于甘蔗、玉米叶片结构及光合作用过程的叙述,正确的是 ( )
① 围绕着维管束的叶肉细胞排列疏松
② 因为叶肉细胞的叶绿体有正常的基粒,所以,水的光解发生在叶肉细胞
③ NADPH储存了能量,并具有还原性
④ CO2中的C首先转移到C4中,然后才转移到C3中
⑤ 光能转化为电能时,电子的最终受体是ATP和NADP+
A.①③⑤ B.①①③④ C.②④⑤ D.②③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com