
题目列表(包括答案和解析)
31.(12分)雄鸡具有打鸣等第二性征,若体内雄激素含量急剧减少,雄鸡的第二性征打鸣会慢慢消失。为验证上述雄激素的功能,请利用下列提供的实验材料与用具,写出实验设计思路,并预测实验结果及结论。
实验材料与用具:雄鸡、含雄激素的饲料、不含雄激素的普通饲料、手术器具(切除器官的具体操作不作要求)等。
(1)实验设计思路:
①
·
·
·
(2)预测实验结果和结论: ▲
30.(14分)在光合作用研究史上有许多经典的实验。请分析回答下列问题:
实验一:
(1)卡尔文将小球藻装在一个密闭容器中,通过通气管向密闭容器中通入CO2,通气管上有一个开关,可以控制CO2的供应,密闭容器周围有光源,通过控制电源开关可以控制光照的有无。
①卡尔文向密闭容器中通入14CO2,经过不同时间的照光(数秒直至数十分钟)后,将小球藻放入沸酒精中处理,其目的是 ▲ ,从而使小球藻中的化合物停留在碳反应的某一阶段;然后分离出各种化合物,测定其放射性。上述实验中卡尔文是通过控制 ▲ 来探究14CO2中碳原子的转移路径。
②卡尔文发现光照30秒,14C 出现在三碳化合物、五碳化合物和六碳化合物、七碳化合物等20余种化合物中;而当把光照时间缩短为5秒时,14C主要出现在一种三磷酸甘油酸(三碳化合物)中,这说明 ▲ 。
③为探究固定CO2的化合物,卡尔文改变某实验条件后,发现RuBP的含量快速升高,其改变的实验条件是 ▲ ,由此得出固定CO2的物质是RuBP。
实验二:
 (2)“半叶法”测定光合作用强度:将对称叶片的一部分(A)遮光,另一部分(B)不做处理,并采用适当的方法阻止物质和能量 的转移,见右图。在适宜光照下照射a小时后,在A、B的对应部位截取同等面积的叶片,烘干称重,分别记为MA、MB,获得相应数据,则可计算出该叶片的光合作用强度,其单位是mg/(dm2·h)。
(2)“半叶法”测定光合作用强度:将对称叶片的一部分(A)遮光,另一部分(B)不做处理,并采用适当的方法阻止物质和能量 的转移,见右图。在适宜光照下照射a小时后,在A、B的对应部位截取同等面积的叶片,烘干称重,分别记为MA、MB,获得相应数据,则可计算出该叶片的光合作用强度,其单位是mg/(dm2·h)。
①请设计一张表格用于记录实验数据。(假设实验选定叶片数目为3)
②a小时内光合作用合成的有机物总量(M)为 ▲ 。
29.(14分)高分子材料M在光聚合物和金属涂料方面有重要用途,M的结构简式为:

 工业上合成M的过程可表示如下:
工业上合成M的过程可表示如下:
已知:A完全燃烧只生成CO2和H2O,其蒸气密度是相同状况下氢气密度的43倍,分子中H、O原子个数比为3:1。它与Na或Na2CO3都能反应产生无色气体。
(1)A中含有的官能团的名称是 。
(2)下列说法正确的是 (填序号字母)。
a.工业上,B主要通过石油分馏获得
b.C的同分异构体有2种(不包括C)
c.D在水中的溶解性很大,遇新制Cu(OH)2悬浊液, 溶液呈绛蓝色
d.E→M的反应是缩聚反应
(3)写出A+D+H3PO4→E反应的化学方程式: ,该反应类型是 反应。
(4)F是A 的一种同分异构体,F的核磁共振氢谱显示分子中有两种不同的氢原子。存在下列转化关系:

写出F、N的结构简式F: N: 。
写出反应①的化学方程式 。
28. (15分)实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为: : ;
为了吸收该反应中产生的尾气,请选择下列中合适的装置 。
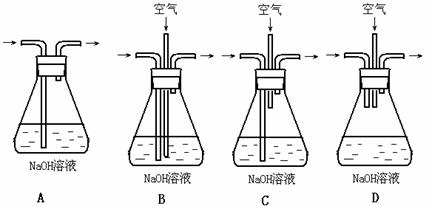
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp[Cu((OH)2]≈10-22, Ksp[Fe((OH)2]≈10-16, Ksp[Fe((OH)3]≈10-38
请回答下列问题:
如开始加入的铜粉为3.2 g,最后所得溶液为500 mL,溶液中含有铁元素0.005 mol。①方案1中的B仪器名称是 。
②为了使铁元素全部沉淀,应调节pH至少为_________。
③方案2中甲物质可选用的是 。
A、CaO B、NaOH C、CuCO3 D、Cu2(OH)2CO3 E、Fe2(SO4)3
④反应中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因 。
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h,升温到60℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.5g。
请回答下列问题:
⑤反应时温度控制在50℃~60℃不宜过高的原因是 ,
⑥本实验CuSO4·5H2O的产率为 。
27.(15分)生物质资源是一种污染小的可再生能源。生物质的主要转化途径及主要产物如下图。
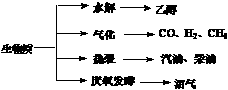
(1)下列有关说法正确的是 。
a.生物质能,本质上能量来源于太阳能
b.由纤维素水解获得的乙醇作燃料是利用了生物质能
c.生物质裂解获得的汽油、柴油等属于纯净物
d.由植物秸杆等厌氧发酵获得的沼气,主要成分是甲烷
(2)由生物质能获得的CO和H2,可以合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者1∶1催化反应,其原子利用率达100%,合成的物质可能是 。
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)甲醇是一种重要的化工原料,工业上合成甲醇的反应:
CO(g)+2H2(g) CH3OH(g)
△H= -90.8kJ·mol-1。
CH3OH(g)
△H= -90.8kJ·mol-1。
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
|
容器 |
甲 |
乙 |
丙 |
|
反应物投入量 |
1molCO 、2molH2 |
1mol CH3OH |
2molCO、4molH2 |
|
CH3OH的浓度(mol/L) |
c1 |
c2 |
c3 |
|
反应的能量变化 |
放出Q1 kJ |
吸收Q2 kJ |
放出Q3 kJ |
|
平衡常数 |
K1 |
K2 |
K3 |
|
反应物转化率 |
α 1 |
α 2 |
α 3 |
下列说法正确的是 。
a. c1 = c2 b. 2Q1 = Q3 c. K1=K3 d. α2+ α3< 100%
(4)在一定温度和压强下,CO和H2催化合成二甲醚的反应为:
3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)
CH3OCH3(g)+CO2(g)
 ①若一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。则:①反应开始时正、逆反应速率的大小:v(正)____v(逆)(填“ >”、“ < ”或“=”),理由是
①若一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。则:①反应开始时正、逆反应速率的大小:v(正)____v(逆)(填“ >”、“ < ”或“=”),理由是
。平衡时n(CH3OCH3)= mol。
②右图为绿色电源“直接二甲醚燃料电池”的工作原理示意图。
b电极是 极;
a电极的反应式为 。
26.(14分)
I.有A、B、C、D四种短周期元素,其中A、D同主族;又已知B和A可形成组成为BA的化合物,其中A的化合价为-1,B和C可形成组成为B2C2的化合物,A、B、C形成的单核离子的核外电子总数相同。
(1)元素A在周期表中的位置是 。
(2)B、C、D可形成组成为BDC的化合物,该化合物水溶液中通入过量CO2发生反应的离子方程式为 。
(3)B2C2在酸性条件下可形成具有二元弱酸性质的物质,该弱酸性物质和B的最高价氧化物对应水化物反应时可生成一种酸式盐,该酸式盐的电子式为 。
II.长期以来一直认为氟的含氧酸不存在。但是自1971年斯图杰尔和阿佩里曼(美)成功地合成了次氟酸后,这种论点被剧烈地动摇了。他们是在0℃以下将氟化物从细冰末的上面通过,得到毫克量的次氟酸。已知次氟酸的分子构成与次氯酸相仿。
⑴次氟酸中氧元素的化合价为 。
⑵下面给出了几个分子和基团化学键的键能(E):
|
|
H2 |
O2 |
F2 |
O-H |
O-F |
H-F |
|
E/(kJ/mol) |
432 |
494 |
155 |
424 |
220 |
566 |
请计算反应:2HFO=2HF+O2的反应热(△H)的近似值为 kJ/mol。
⑶次氟酸刹那间能被热水所分解,生成一种常见的物质H2O2,写出次氟酸与热水反应的化学方程式: 。
(4)1986年,化学家Karl Christe首次用2K2MnF6 + 4SbF5 === 4KSbF6 + 2MnF3 + F2↑化学方法制得了F2。该反应中被还原的元素化合价从 价变为 价,若反应中生成标准状况下11.2 L的F2,则有 mol电子发生转移。
25. (22分)如图所示,AB是两块竖直放置的平行金属板,相距为2L,分别带有等量的正、负电荷,在两板间形成电场强度大小为E的匀强电场。A板上有一小孔(它的存在对两板间匀强电场分布的影响可忽略不计),孔中有一条与板垂直的水平光滑绝缘轨道,一个质量为m,电荷量为q(q>0)的小球(可视为质点),在外力作用下静止在轨道的中点P处。一自然长度为L的轻弹簧左端固定在距A板左侧L处挡板上,右端固定一块轻小的绝缘材料制成的薄板Q。撤去外力释放带电小球,它将在电场力作用下由静止开始向左运动,穿过小孔后(不与金属板A接触)与薄板Q一起压缩弹簧,由于薄板Q及弹簧的质量都可以忽略不计,可认为小球与Q接触过程中不损失机械能。小球从接触Q开始,经过一段时间第一次把弹簧压缩至最短,然后又被弹簧弹回。由于薄板Q的绝缘性能有所欠缺,使得小球每次离开Q瞬间,小球的电荷量都损失一部分,而变成刚与Q接触时小球电荷量的1/k
(k>l)。求:
(22分)如图所示,AB是两块竖直放置的平行金属板,相距为2L,分别带有等量的正、负电荷,在两板间形成电场强度大小为E的匀强电场。A板上有一小孔(它的存在对两板间匀强电场分布的影响可忽略不计),孔中有一条与板垂直的水平光滑绝缘轨道,一个质量为m,电荷量为q(q>0)的小球(可视为质点),在外力作用下静止在轨道的中点P处。一自然长度为L的轻弹簧左端固定在距A板左侧L处挡板上,右端固定一块轻小的绝缘材料制成的薄板Q。撤去外力释放带电小球,它将在电场力作用下由静止开始向左运动,穿过小孔后(不与金属板A接触)与薄板Q一起压缩弹簧,由于薄板Q及弹簧的质量都可以忽略不计,可认为小球与Q接触过程中不损失机械能。小球从接触Q开始,经过一段时间第一次把弹簧压缩至最短,然后又被弹簧弹回。由于薄板Q的绝缘性能有所欠缺,使得小球每次离开Q瞬间,小球的电荷量都损失一部分,而变成刚与Q接触时小球电荷量的1/k
(k>l)。求:
(l)弹簧第一次压缩到最左边时的弹性势能;
(2)小球在与B板相碰之前,最多能与薄板Q碰撞多少次;
(3)设A板的电势为零,当k=2、且小孔右侧的轨道粗糙与带电小球间的滑动摩擦力FJ= 时,求带电小球初、末状态的电势能变化量。
时,求带电小球初、末状态的电势能变化量。
23. (16分)为了解决高楼救险中云梯高度不够高的问题,可在消防云梯上再伸出轻便的滑杆。如图为一次消防演习中模拟解救被困人员的示意图,被困人员使用安全带上的挂钩挂在滑杆上、沿滑杆下滑到消防云梯上逃生。为了安全,被困人员滑到云梯顶端的速度不能太大,通常滑杆由AO、OB两段直杆通过光滑转轴在O处连接,滑杆A端用挂钩钩在高楼的固定物上,且可绕固定物自由转动,B端用铰链固定在云梯上端,且可绕铰链自由转动,以便调节被困人员滑到云梯顶端的速度大小。设被困人员在调整好后的滑杆上下滑时滑杆与竖直方向的夹角保持不变,被困人员可看作质点、不计过O点时的机械能损失。已知AO长L1 = 6m、OB长L2 = 12m、竖直墙与云梯上端点B的水平距离d = 13.2m,被困人员安全带上的挂钩与滑杆AO间、滑杆OB间的动摩擦因数均为μ= 5/6。被困人员到达云梯顶端B点的速度不能超过6m/s,取g=10m/s2。
(16分)为了解决高楼救险中云梯高度不够高的问题,可在消防云梯上再伸出轻便的滑杆。如图为一次消防演习中模拟解救被困人员的示意图,被困人员使用安全带上的挂钩挂在滑杆上、沿滑杆下滑到消防云梯上逃生。为了安全,被困人员滑到云梯顶端的速度不能太大,通常滑杆由AO、OB两段直杆通过光滑转轴在O处连接,滑杆A端用挂钩钩在高楼的固定物上,且可绕固定物自由转动,B端用铰链固定在云梯上端,且可绕铰链自由转动,以便调节被困人员滑到云梯顶端的速度大小。设被困人员在调整好后的滑杆上下滑时滑杆与竖直方向的夹角保持不变,被困人员可看作质点、不计过O点时的机械能损失。已知AO长L1 = 6m、OB长L2 = 12m、竖直墙与云梯上端点B的水平距离d = 13.2m,被困人员安全带上的挂钩与滑杆AO间、滑杆OB间的动摩擦因数均为μ= 5/6。被困人员到达云梯顶端B点的速度不能超过6m/s,取g=10m/s2。
(1)现测得OB与竖直方向的夹角为53o,请分析判断被困人员滑到B点是否安全。(sin37o=0.6, cos37o=0.8)
(2)若云梯顶端B点与竖直墙间的水平距离保持不变,求能够被安全营救的被困人员与云梯顶端B的最大竖直距离。(结果可用根式表示)
 24,(20分)如图所示,竖直平面内有光滑且不计电阻的两道金属导轨,宽都为L= 1m,上方安装有一个阻值R =1Ω的定值电阻。两根质量都为m,电阻都为r,完全相同的金属杆靠在导轨上,金属杆与导轨等宽且与导轨接触良好,虚线下方的区域内存在匀强磁场,磁感应强度B =1T。将金属杆1固定在磁场的上边缘,金属杆2从磁场边界上方ho=0.2m处由静止释放,进入磁场后恰作匀速运动,求:
24,(20分)如图所示,竖直平面内有光滑且不计电阻的两道金属导轨,宽都为L= 1m,上方安装有一个阻值R =1Ω的定值电阻。两根质量都为m,电阻都为r,完全相同的金属杆靠在导轨上,金属杆与导轨等宽且与导轨接触良好,虚线下方的区域内存在匀强磁场,磁感应强度B =1T。将金属杆1固定在磁场的上边缘,金属杆2从磁场边界上方ho=0.2m处由静止释放,进入磁场后恰作匀速运动,求:
(l)金属杆的质量m为多大?
(2)将金属杆1仍然固定在磁场上边缘,金属杆2从磁场边界上方h = 0.15m高处静止释放,经过一段时间后再次匀速,此过程整个回路中产生了0.05J的热量,则此过程流过电阻R的电量为q为多少?
(3)金属杆2仍然从离开磁场边界h=0.15m高处静止释放,在进入磁场的同时静止释放金属杆1,两金属杆运动了一段时间后都开始了匀速运动,试求出金属杆1和金属杆2匀速运动时的速度分别是多少?(两个电动势分别为E1、E2不同的电源串联时,电路中总的电动势E= E1+ E2)。
21.某同学利用气垫导轨做“探究碰撞中的不变量”的实验;气垫导轨装置如图所示,所用的气垫导轨装置由导轨、滑块、弹射架、光电门等组成。

(l)下面是实验的主要步骤:
①安装好气垫导轨,调节气垫导轨的调节旋钮,使导轨水平;
②向气垫导轨通入压缩空气;
③接通光电计时器;
④把滑块2静止放在气垫导轨的中间;
⑤滑块1挤压导轨左端弹射架上的橡皮绳;
⑥释放滑块1,滑块1通过光电门1后与左侧固定弹簧的滑块2碰撞,碰后滑块1和滑块2依次通过光电门2,两滑块通过光电门后依次被制动;
⑦读出滑块通过两个光电门的挡光时间分别为滑块1通过光电门1的挡光时间△t1 = 10.01ms,通过光电门2的挡光时间△t2 = 49 . 99ms, 滑块2通过光电门2的挡光时间△t3=8.35ms;
⑧测出挡光片的宽度d = 5mm,测得滑块1(包括撞针)的质量为ml= 300g,滑块2(包括弹簧)质量为m2 = 200g;
(2)数据处理与实验结论:
①实验中气垫导轨的作用是
②碰撞前滑块l的速度vl为 m/s;碰撞后滑块1的速度v2为 m/s;滑块2的速度v3为 m/s;(结果保留两位有效数字)
③在误差允许的范围内,通过本实验,同学们可以探究出哪些物理量是不变的?通过对实验数据的分析说明理由。(至少回答2个不变量)。
a.
b.
 22(10分)现想要测量某电源的电动势E和内电阻r(E约为4.5V,r约为1.5Ω),而手头只有以下器材:
22(10分)现想要测量某电源的电动势E和内电阻r(E约为4.5V,r约为1.5Ω),而手头只有以下器材:
A.电源(电动势E约为4.5V,内电阻r约为1.5Ω)
B.量程0-3V内阻很大的电压表(可看成理想电压表)
C.量程0-0.5A内阻约为1Ω电流表(不能看成理想电流表)
D.滑动变阻器R(阻值调节范围0-20Ω)
E.定值电阻Ro(阻值为4Ω)
F.电键S、导线若干
(1)某同学根据上面给出的实验器材,设计出实验电路图如图所示进行实验,电路接法正确,线路、器材完好,却没有办法测出该电源电动势和内电阻,请你通过估算帮他分析不能成功的原因。
(2)另一同学在上面实验电路图的基础上稍加改进,便可以方便地测量出电源电动势和内电阻的值,请你在答卷的虚线框中画出能测出电源电动势和内电阻的实验电路图。
(3)如果利用正确的实验电路图,通过改变滑动变阻器的阻值,得到两组电压和电流的读数分别为U1、I1和U2、I2,试根据这两组电压和电流的读数表示出被测电源的电动势的表达式E= ,内电阻的表达式r= (分别用题中所给的字母表示)。
20.如图所示,边界OA与OC之间分布有垂直纸面向里的匀强磁场,边界OA上有一粒子源S。某一时刻,从S平行于纸面向各个方向发射出大量带正电的同种粒子(不计粒子的重力及粒子间的相互作用),所有粒子的初速度大小相同,经过一段时间有大量粒子从边界OC射出磁场。已知∠AOC = 60o,从边界OC射出的粒子在磁场中运动的最长时间等于T/2(T为粒子在磁场中运动的周期),则从边界OC射出的粒子在磁场中运动的时间可能为( )
A. T/3 B .T/4 C. T/6 D. T/8
第Ⅱ卷 (非选择题共180分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com