
题目列表(包括答案和解析)
1.下列有关物质的结构和功能的叙述中,正确的是
A.线粒体可独立完成有氧呼吸过程,叶绿体可独立完成光合作用过程
B.DNA聚合酶连接DNA分子片段,限制性内切酶切开DNA分子片段
C.动物细胞的主要能源物质是糖类,植物细胞的主要能源物质是脂肪
D.细胞膜上载体的本质是蛋白质,基因工程中的(运)载体的本质是DNA
(二)选考题(每科选做1题,共做3题,共45分)
(一)必考题(共11道题,129分)
22. (5分)如图是该实验中得到的一条较理想的纸带,O点是打上去的第1个点,有关长度在图中已标明.选取N点验证机械能守恒定律,下面列举的计算打N点时重锤速度的计算方法正确的是
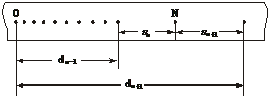
A.vN=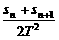 B.vN=
B.vN=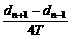
C.vN=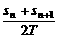 D.vN=
D.vN=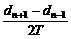
23(10分).如图所示是测量待测电阻Rx的电路图,由于电压表、电流表有内阻对实验产生影响,使测量值出现误差,为使测量值更准确,分别测有两组数据:S接a时,电压表、电流表示数分别为U1、I1;S接b时,电压表、电流表示数分别为U2、I2.
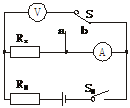
(1)在如图所示实物图上用导线连接好电路;
(2)如果电压表示数几乎不变,电流表示数变化较大,待测电阻Rx=_______;
(3)如果电流表示数几乎不变,电压表示数变化较大,待测电阻Rx=_______.
24.(14分) .消防队员为缩短下楼的时间,往往抱着竖直的杆直接滑下。假设一名质量为60kg、训练有素的消防队员从七楼(即离地面18m的高度)抱着竖直的杆以最短的时间滑下。已知杆的质量为200kg,消防队员着地的速度不能大于6m/s,手和腿对杆的最大压力为1800N,手和腿与杆之间的动摩擦因数为0.5,设当地的重力加速度g=10m/s2。假设杆是搁在地面上的,杆在水平方向不能移动。试求:(1)消防队员下滑过程中的最大速度;(2)消防队员下滑过程中杆对地面的最大压力;(3)消防队员下滑的最短的时间。
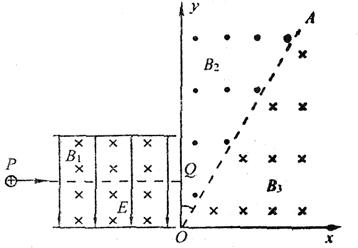
25.(18分)如图所示的两平行金属板间,存在相互垂直的匀强磁场和匀强电场,磁场的磁感应强度B1= 0.40T,方向垂直纸面向里,电场强度E=2.0×105V/m,PQ为板间中线.紧靠平行板右侧边缘建立平面直角坐标系xOy,在第一象限内,存在着以A0为理想边界的匀强磁场B2和B3. B2和B3的磁感应强度大小相等,B2的方向垂直纸面向外,B3的方向垂直纸面向里.边界A0和y轴间的夹角为300.一束带电荷量q=2.5×10-8C、质量m=4.5×10-15kg的带正电的微粒从P点射入平行板间,沿中线PQ做直线运动,穿出平行板区域后从Y轴上坐标为(0,0.3m)的Q点垂直y轴射入磁场B2区,不计微粒的重力,则:
(1)微粒在平行板间运动的速度为多大?
(2)要使进入第一象限的微粒不能通过AO边界,则匀强磁场B2的磁感应强度大小应满足什么条件?
(3)若匀强磁场B2和B3的磁感应强度大小为0.60T,求微粒从Q点进入第一象限开始.第6次通过A0边界线时的点到原点O的距离L和经过的时间t.(答案可保留根式)
26.(15分)在下列物质转化关系中,反应的条件和部分产物已略去。
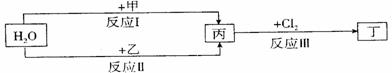
回答下列问题:
(1)若甲、乙是两种常见金属,反应Ⅲ是工业制盐酸的反应。
①反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则工业上生产甲的一般方法是 。
A.热分解法 B.热还原法 C.电解法
②反应Ⅱ中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式
是 。
③通过比较反应I、Ⅱ的反应条件,可得出甲的金属性比乙的金属性 (填 “强”或“弱”),比较二者金属性强弱的依据还可以是 (写出一种即可)。
(2)若甲、乙是化合物,且反应Ⅲ是工业制漂白粉的反应。
①反应Ⅲ的化学方程式是 。
②反应I的另一种产物为有机物,则该有机物的电子式是 。
③反应Ⅱ是化合反应。乙可与硫酸铵共热反应制氨气,则此反应的化学方程式是 。
④在饱和氯水中加块状石灰石,能制得较浓HClO溶液,同时放出一种气体。其反应的离子方程式是 。
27.(16分)为证明化学反应有一定的限度,进行如下探究活动:
I.取5mL 0.1mol/L的KI溶液,滴加5-6滴FeCl3稀溶液;
Ⅱ.继续加入2mL CCl4振荡
Ⅲ.取萃取后的上层清液,滴加KSCN溶液。
(1)探究活动I的实验现象为 。
探究活动Ⅱ的实验现象为 。
(2)探究活动Ⅲ的意图是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色。对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+ 猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察。
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。
结合新信息,现设计以下实验方案验证猜想:
①请完成下表
|
实验操作 |
现象和结论 |
|
步骤一: |
若产生蓝色沉淀,则
。 |
|
步骤二: |
若乙醚层呈血红色,则
。 |
②写出实验操作“步骤一”中的反应离子方程式: 。
Ⅳ.为了测定探究活动I中的FeCl3稀溶液的浓度,现进行以下操作:
①移取25.00mLFeCl3稀溶液至锥形瓶中,加入 用作指示剂,再用c mol/LKI标准溶液滴定,达到滴定终点时的现象是 。
②重复滴定三次,平均耗用c mol/LKI标准溶液VmL,则FeCl3稀溶液
物质的量浓度为 mol/L。
③若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果 (填“偏高”或“偏低”或“不变”)。
28.(14分)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
(1)已知:N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ/mol
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ/mol
尾气转化的反应之一:2NO(g)+2CO(g)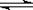 N2(g)+2CO2(g) △H
=
。
N2(g)+2CO2(g) △H
=
。
 (2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
C(NO) (×10-4 mol/L) |
10.0 |
4.50 |
2.50 |
1.50 |
1.00 |
1.00 |
|
C(CO) (×10-3 mol/L) |
3.60 |
3.05 |
2.85 |
2.75 |
2.70 |
2.70 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2s内的平均反应速率v (N2) = ___________________。
②在该温度下,反应的平衡常数K = 。(只写出计算结果)
③对于该可逆反应,通过综合分析以上信息,至少可以说明 (填字母)。
A.该反应的反应物混合后很不稳定
B.该反应一旦发生将在很短的时间内完成
C.该反应体系达到平衡时至少有一种反应物的百分含量较小
D.该反应在一定条件下能自发进行
E.该反应使用催化剂意义不大
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是 。
 A.负极的电极反应式为:CO+O2-―2e-=CO2
A.负极的电极反应式为:CO+O2-―2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
29.(8分)下图表示神经、免疫、内分泌三大系统相互调节的部分示意图,请据图回答:
(1)由图可知,神经系统可通过突触前膜 ,来调节免疫细胞的活动。
(2)免疫活性物质是由免疫细胞或其他细胞产生的发挥免疫作用的物质,请举两例:
、 。
(3)若某抗原引起机体产生的抗体结合到呼吸道上皮细胞的表面,当再接受同一抗原刺激后引起哮喘,这在免疫学上称为 。
(4)机体稳态的维持离不开细胞间的信息交流,动物细胞间进行信息交流一方面可以通过细胞分泌的信息分子(如 、 等)作用于靶细胞来实现;二是通过 来实现信息交流,例如吞噬细胞将抗原呈递给T细胞就是通过这一途径实现的。高等植物细胞之间还可以通过 来
进行信息交流
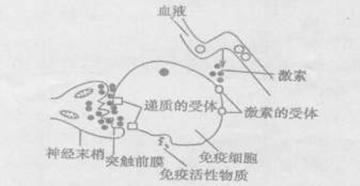
30.(8分)下图装置可以用来测量呼吸作用所消耗的氧气量。现有装置两套,分别以20粒萌发的种子和4条蚯蚓为材料,每隔l0分钟记录一次有色液滴在刻度玻璃管上的读数,结果如下表所示。
(1)分析表格中的数据,进行种子萌发实验时,有色液体移动的最大速率是 。请写出萌发的种子进行有氧呼吸的反应式 ,蚯蚓进行无氧呼吸的产物是
(2)动物和萌发的种子实验都表明,在一段时间后,有色液滴移动的速度逐渐减缓,这是因为 。某同学根据表格中的数据,得出“萌发的种子的呼吸速率比蚯蚓的呼吸速率大”的结论。你认为是否正确? ,请说明理由 。
(3) 若要排除外界偶发因素对萌发的种子的实验结果的影响,应如何设置对照组
(4)若要在原实验的基础上测定20粒萌发的种子在单位时间内产生的CO2,则补充的对照组应在原装置上作何修改
31.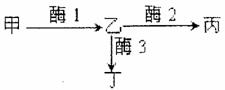 (16分)日本明蟹壳色有三种情况:灰白色、青色和花斑色。其生化反应原理如图所示。基因A控制合成酶1,基因B控制合成酶2,基因b控制合成酶3。基因a控制合成的蛋白质无酶1活性,基因a纯合后,物质甲(尿酸盐类)在体内过多积累,导致成体会有50%死亡。甲物质积累表现为灰白色壳,丙物质积累表现为青色壳,丁物质积累表现为花斑色壳。请回答:
(16分)日本明蟹壳色有三种情况:灰白色、青色和花斑色。其生化反应原理如图所示。基因A控制合成酶1,基因B控制合成酶2,基因b控制合成酶3。基因a控制合成的蛋白质无酶1活性,基因a纯合后,物质甲(尿酸盐类)在体内过多积累,导致成体会有50%死亡。甲物质积累表现为灰白色壳,丙物质积累表现为青色壳,丁物质积累表现为花斑色壳。请回答:
(1)明蟹的青色壳是由 对基因控制的。青色壳明蟹的基因型有 种,
分别是 。
(2)两只青色壳明蟹交配,后代成体只有灰白色明蟹和青色明蟹,且比例为1:6。亲本
基因型组合为 或 。
(3)基因型为AaBb的两只明蟹杂交,后代的成体表现为 ,其比例为 。
(4)从上述实验可以看出,基因通过控制 来控制代射过程,进而控制生物
体的性状。
32.某食品厂、造纸厂的工业有机废水和居民生活污水都向一条河流中排放,使原本清澈的河水变得又黑又臭。后来进行了如下处理,情况大有改观。
水从高处向下流形成的景观叫“跌水”。跌水充氧技术的原理是:生活污水首先进入沼气池,经过沼气池处理后的污水再用泵提升进入多级跌水池。跌水池分多格串行,内装组合填料,其借助生长在填料上的微生物去除有机物;经过跌水池的污水一部分回流入沼气池,另一部分进入水耕型蔬菜池。这项技术被称为是生物处理与生态处理相结合的、低能耗的污水处理新工艺。
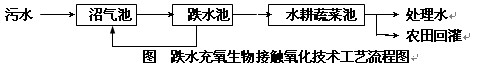
(1)以前,大量污水的排放使河水变得黑臭,从生态系统的稳定性的角度分析其原因是_______________________________________。
(2)沼气池中沼气发酵是一个极其复杂的生物化学过程,包括各种不同类型微生物所完成的各种代谢途径。如S-菌系分解乙醇产H2,H2对它继续分解乙醇有阻抑作用,而MOH-菌系可利用H2和CO2合成沼气中的甲烷,以上两种菌系的关系在生物学上称为__________________________。
(3)经过栽培水耕型蔬菜的水中__________ 元素(至少两种)明显减少。
(4)水耕型蔬菜池还生活着一些细菌、原生动物和其他生物类群,实质就是一个小型的__________________________。水耕型蔬菜如空心菜、水芹菜、茭白等的生长,对水中_____________(一类植物)的繁殖和生长起了竞争抑制作用,实现了水体净化,并进一步实现了生态系统的_____________多层次的循环利用。
(5)为了检验污水处理的效果,常测定BOD5(5日生化需氧量)的值,BOD5通常指20℃下,1L污水中所含有机碳源在微生物氧化时,5日内所消耗分子氧的毫克数。若假设原来100mL污水中的有机物含量为2.1g,等价于1.8g葡萄糖的耗氧量,污水处理后测得BOD5的值为190mg/L,则污水净化率达到_____________左右(以BOD5减少的百分率表示)。
14关于物理学研究方法,以下说法错误的是
A.在用实验探究加速度、力和质量三者之间的关系时,采用控制变量法
B.伽利略对自由落体运动的研究,以及理想斜面实验探究力和运动的关系时,采用实验归纳法
C.某些情况下,不考虑物体的大小和形状,突出质量要素,把物体看做质点;点电荷类似力学中的质点,也是一种理想化的物理模型
D.在利用速度-时间图象推导匀变速直线运动的位移公式时,把运动过程无限划分,采用微元法
15、 如图所示,光滑水平面上放置质量分别为m、2m和3m的三个木块,其中质量为2m和3m的木块间用一不可伸长的轻绳相连,轻绳能承受的最大拉力为T。现用水平拉力F拉其中一个质量为3m的木块,使三个木块以同一加速度运动,则以下说法正确的是:
如图所示,光滑水平面上放置质量分别为m、2m和3m的三个木块,其中质量为2m和3m的木块间用一不可伸长的轻绳相连,轻绳能承受的最大拉力为T。现用水平拉力F拉其中一个质量为3m的木块,使三个木块以同一加速度运动,则以下说法正确的是:
A.质量为2m的木块受到四个力的作用
B.当F逐渐增大到T时,轻绳刚好被拉断
C.当F逐渐增大到1.5T时,轻绳还不会被拉断
D.轻绳刚要被拉断时,质量为m和2m的木块间的摩擦力为2T/3
16、2009年2月11日,俄罗斯的“宇宙-2251”卫星和美国“铱-33”卫星在西伯利亚上空约805km处发生碰撞。这是历史上首次发生的完整在轨卫星碰撞事件。碰撞过程中产生的大量碎片可能会影响太空环境。假定有甲、乙两块碎片,绕地球运动的轨道都是圆,甲的运行速率比乙的大,则下列说法中正确的是
A.甲的运行周期一定比乙的长 B.甲距地面的高度一定比乙的高
C.甲的向心力一定比乙的小 D.甲的加速度一定比乙的大
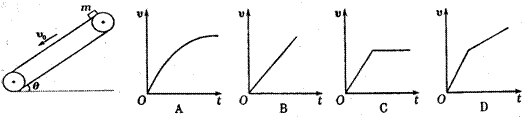 17、如图所示,足够长的传送带与水平面夹角为
17、如图所示,足够长的传送带与水平面夹角为 ,以速度
,以速度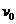 逆时针匀速转动,在传送带的上端轻轻放置一个质量为m的小木块,小木块与传送带间的动摩擦因数
逆时针匀速转动,在传送带的上端轻轻放置一个质量为m的小木块,小木块与传送带间的动摩擦因数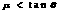 ,则下图中能客观地反映小木块的速度随时间变化关系的是:
,则下图中能客观地反映小木块的速度随时间变化关系的是:
18、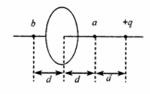 如图所示,圆形薄板均匀带电,其过圆心的轴线上,有一带电量为+q的点电荷,跟带电薄板相距2d。若图中a点处的电场强度为零,则图中b点处的电场强度大小是( )
如图所示,圆形薄板均匀带电,其过圆心的轴线上,有一带电量为+q的点电荷,跟带电薄板相距2d。若图中a点处的电场强度为零,则图中b点处的电场强度大小是( )
A.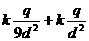 B.
B.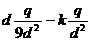
C.0 D 
19、如果所示,空间中存在竖直向上的匀强电场,一个质量为m的小球沿虚线作直线运动,轨迹上A、B两点的竖直高度差为h,重力加速度为g,则在小球从B到A的过程中:
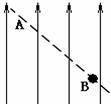 A、静电力对小球做功
A、静电力对小球做功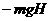
B、小球的动能保持不变
C、小球的机械能增加
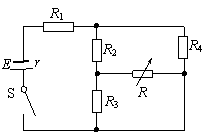 D、小球的重力势能和电势能的和增加
D、小球的重力势能和电势能的和增加
20、如图所示的电路中,电源电动势为E,内阻为r,R为可变电阻,其余电阻为定值电阻.则开关S闭合后,当R变小时,以下说法正确的是:
A.电阻R1的功率变大
B.电阻R2的功率变小
C.电阻R3的功率变大
D.电阻R4的功率变小
21、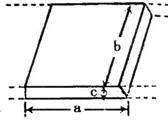 电磁流量计广泛应用于测量可导电液体(如污水)在管中的流量(在单位时间内通过管内横截面的流体的体积).为了简化,假设流量计是如图所示的横截面为长方形的一段管道.其中空部分的长、宽、高分别为图中的a、b、c.流量计的两端与输送流体的管道相连接(图中虚线).图中流量计的上下两面是金属材料,前后两面是绝缘材料.现于流量计所在处加磁感应强度B的匀强磁场,磁场方向垂直前后两面.当导电流体稳定地流经流量计时,在管外将流量计上、下两表面分别与一串接了电阻R的电流表的两端连接,I表示测得的电流值.已知流体的电阻率为ρ,不计电流表的内阻,则可求得流量为
电磁流量计广泛应用于测量可导电液体(如污水)在管中的流量(在单位时间内通过管内横截面的流体的体积).为了简化,假设流量计是如图所示的横截面为长方形的一段管道.其中空部分的长、宽、高分别为图中的a、b、c.流量计的两端与输送流体的管道相连接(图中虚线).图中流量计的上下两面是金属材料,前后两面是绝缘材料.现于流量计所在处加磁感应强度B的匀强磁场,磁场方向垂直前后两面.当导电流体稳定地流经流量计时,在管外将流量计上、下两表面分别与一串接了电阻R的电流表的两端连接,I表示测得的电流值.已知流体的电阻率为ρ,不计电流表的内阻,则可求得流量为
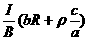

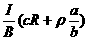
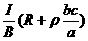
A. B. C. D.
第Ⅱ卷(必考题129分,选考题45分,共174分)
本卷包括必考题和选考题两部分。第22-32题为必考题,每个试题考生都做答;第33题-39题为选考题,考生根据要求作答。
13.有20 mL 0.1 mol·L-1 ①Na2CO3、②CH3COONa、③NaOH三种溶液,下列说法正确的
A. 三种溶液pH的大小顺序是 ③>②>①
B. 若将三种溶液稀释相同倍数,pH变化最大的是②
C. 若分别加入20 mL 0.1 mol·L-1 盐酸后,pH最大的是①
D. 若分别跟相同浓度的稀硫酸恰好完全反应,消耗硫酸的体积为 ①>③>②
12.下列有关现象及对应的离子方程式或化学反应方程式不正确的是:
A.草酸可使酸性高锰酸钾溶液褪色,其离子方程式为:
2MnO4- + 5C2O42- + 16H+ = 2Mn2+ + 10CO2 ↑+ 8H2O
B.S2O32-在酸性环境中不存在,其反应的离子方程式为:
S2O32-+ 2H+ = S↓ + SO2↑ + H2O
C.K2Cr2O7在水中存在平衡:Cr2O72- + H2O 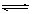 2
CrO42- + 2H+
2
CrO42- + 2H+
可由溶液颜色判断其酸碱性
D.SOCl2是一种液态化合物,遇水有雾及刺激性气味气体产生,其化学反应方程式为:
SOCl2 + H2O = 2HCl↑ + SO2 ↑
11. 如图所示装置进行实验,将液体a逐滴滴入到固体b中,下列叙述正确的是
|
 |
10.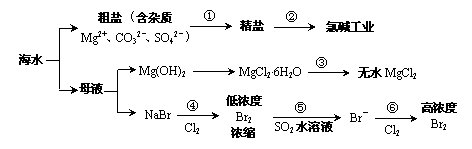 根据下图海水综合利用的工业流程图,判断下列说法正确的是
根据下图海水综合利用的工业流程图,判断下列说法正确的是
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质
B.在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
C.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
D.在过程④、⑥反应中每氧化0.2 mol Br- 需消耗2. 24 L Cl2
9.实验室为监测空气中汞蒸气的含量,通常悬挂有CuI的滤纸,根据滤纸是否变色或颜色发生变化的时间来判断空气中汞的含量,其反应为:4CuI+Hg=Cu2HgI4+2Cu。以下有关说法正确的是
A.上述反应的产物Cu2HgI4中,Hg的化合价为+2
B.上述反应中CuI既是氧化剂,又是还原剂 C.上述反应中Hg与Cu均发生氧化反应
D.上述反应中生成 64g Cu时,转移的电子数为2×6.02×1023
8.下列排列顺序正确的是
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HC1O4 ④结合质子能力:OH->CH3COO->C1-
A.①③ B.②④ C.①④ D.②③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com