
题目列表(包括答案和解析)
9、


 BD 解析:这是一道有关字母化方程式的计算,可第二次反应后,D的质量为x,同时参加反应的C的质量为y,第一次反应后,参加反应的B的质量为z。
BD 解析:这是一道有关字母化方程式的计算,可第二次反应后,D的质量为x,同时参加反应的C的质量为y,第一次反应后,参加反应的B的质量为z。



 由题意可知,该反应可表示为:A +
B + C
== D
由题意可知,该反应可表示为:A +
B + C
== D



 15g z
30g
15g z
30g



 25g 15g y x
25g 15g y x



 列出比例比可求出:x=50g,则选项B正确;反应中A和B的质量比为25g:15g=5:3,故选项C错误;y=10g,则反应中A和C的质量比为25g:10g=5:2,所以选项D正确;
列出比例比可求出:x=50g,则选项B正确;反应中A和B的质量比为25g:15g=5:3,故选项C错误;y=10g,则反应中A和C的质量比为25g:10g=5:2,所以选项D正确;



 z=9g,则第一次反应后剩余的B的质量为15g-9g=6g,所以选项A错误。
z=9g,则第一次反应后剩余的B的质量为15g-9g=6g,所以选项A错误。
8、


 A 解析:首先要分析并写出本题所涉及的两个化学方程式:
A 解析:首先要分析并写出本题所涉及的两个化学方程式:



 2Cu+O2
2Cu+O2
 2CuO C+O2
2CuO C+O2
 CO2 依题意可知:Cu→CuO时增加的氧元素的质量与C→CO2时减少的C元素的质量相等。即原混合物中铜粉与碳粉的质量比与氧化铜中铜元素与氧元素的质量比相等。在CuO中,Cu:O=64:16=4:1,即原混合物中铜粉与碳粉的质量比也为4:1。
CO2 依题意可知:Cu→CuO时增加的氧元素的质量与C→CO2时减少的C元素的质量相等。即原混合物中铜粉与碳粉的质量比与氧化铜中铜元素与氧元素的质量比相等。在CuO中,Cu:O=64:16=4:1,即原混合物中铜粉与碳粉的质量比也为4:1。



 点拨:此题的关键是要判断出混合物在空气中充分灼烧后的物质是CuO,CuO的质量与原混合物的质量相等,从而得出原混合物中失去碳的质量与生成物CuO中的氧元素质量相等,即要找出使总质量不变的等量关系。
点拨:此题的关键是要判断出混合物在空气中充分灼烧后的物质是CuO,CuO的质量与原混合物的质量相等,从而得出原混合物中失去碳的质量与生成物CuO中的氧元素质量相等,即要找出使总质量不变的等量关系。
7、


 C 解析:此题考查学生根据化学方程式计算与化合价知识综合运用能力。解法是设金属X的相对原子质量为9a,则Y的相对原子质量为8a;设X的化合价为x,Y的化合价为y,设相等的质量为w,则化学方程式可写成:
C 解析:此题考查学生根据化学方程式计算与化合价知识综合运用能力。解法是设金属X的相对原子质量为9a,则Y的相对原子质量为8a;设X的化合价为x,Y的化合价为y,设相等的质量为w,则化学方程式可写成:



 2X+2xHCl===2XClx+xH2↑ 2Y+2yHCl===2YCly+yH2↑
2X+2xHCl===2XClx+xH2↑ 2Y+2yHCl===2YCly+yH2↑



 18a
2x 16a
2y
18a
2x 16a
2y



 w
w
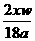 w
w
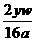









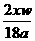 4
4







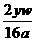 3
3




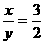 即x为+3价,y为+2价。
即x为+3价,y为+2价。



 点拨:化学式中的原子个数及化学方程式中的化学计量数根据题意都可写成字母或代数式的形式,在配平化学方程式及利用化学方程式进行计算时,可把这些字母或代数式看一个数值,采取适当的方法配平,按正确的步骤进行解答。
点拨:化学式中的原子个数及化学方程式中的化学计量数根据题意都可写成字母或代数式的形式,在配平化学方程式及利用化学方程式进行计算时,可把这些字母或代数式看一个数值,采取适当的方法配平,按正确的步骤进行解答。
6、


 D 解析:加热NaHCO3生成Na2CO3、H2O、CO2,在270℃时,H2O和CO2一样变成气体散失了,即减少的质量就是生成的CO2与H2O的质量之和。
D 解析:加热NaHCO3生成Na2CO3、H2O、CO2,在270℃时,H2O和CO2一样变成气体散失了,即减少的质量就是生成的CO2与H2O的质量之和。



 解法一:设生成的H2O的质量为x,生成的CO2的质量为y。根据化学方程式求出H2O和CO2的质量分别为:1.8g和4.4g,即减少的总质量为1.8g+4.4g=6.2g。
解法一:设生成的H2O的质量为x,生成的CO2的质量为y。根据化学方程式求出H2O和CO2的质量分别为:1.8g和4.4g,即减少的总质量为1.8g+4.4g=6.2g。



 解法二:设生成的Na2CO3的质量为x。利用化学方程式求出生成Na2CO3的质量为10.6g,即减少的质量为:16.8g-10.6g=6.2g。
解法二:设生成的Na2CO3的质量为x。利用化学方程式求出生成Na2CO3的质量为10.6g,即减少的质量为:16.8g-10.6g=6.2g。



 点拨:要充分挖掘题目中的条件,考虑到影响物质质量变化的各种因素,如放出气体、生成沉淀、生成水的蒸发等。
点拨:要充分挖掘题目中的条件,考虑到影响物质质量变化的各种因素,如放出气体、生成沉淀、生成水的蒸发等。
5、


 B 解析:根据质量守恒定律,当试管里的固体质量为3.0g时,生成O2的质量为3.16g-3.0g=0.16g。利用化学方程式可计算出生成0.16gO2参加反应的KMnO4的质量为1.58g,所以试管里的KMnO4没有完全反应,故选B。
B 解析:根据质量守恒定律,当试管里的固体质量为3.0g时,生成O2的质量为3.16g-3.0g=0.16g。利用化学方程式可计算出生成0.16gO2参加反应的KMnO4的质量为1.58g,所以试管里的KMnO4没有完全反应,故选B。
4、


 A 解析:根据二氧化碳和水的质量比为22:9,可计算出碳、氢两种元素的质量比为6:1,只有A选项中C6H12O6 碳、氢两种元素的质量比为6:1。
A 解析:根据二氧化碳和水的质量比为22:9,可计算出碳、氢两种元素的质量比为6:1,只有A选项中C6H12O6 碳、氢两种元素的质量比为6:1。



 点拨:本题虽然利用化学方程式也可比较得出答案,但根据质量守恒定律,化学反应前后元素的质量相等,却更为简便。
点拨:本题虽然利用化学方程式也可比较得出答案,但根据质量守恒定律,化学反应前后元素的质量相等,却更为简便。
3、


 B 解析:写出这4个反应的化学方程式,按O2的化学计量数为1进行配平,计算每种物质与O2的质量比,然后比较得出答案。
B 解析:写出这4个反应的化学方程式,按O2的化学计量数为1进行配平,计算每种物质与O2的质量比,然后比较得出答案。




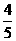 P+O2
P+O2

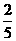 PO5
2H2+O2
PO5
2H2+O2
 2H2O S+O2
2H2O S+O2
 SO2 C+O2
SO2 C+O2
 CO2
CO2



 消耗32份质量的O2所需4种物质的相对质量分别为:24.8、4、32、12,所以相同质量的这4种物质消耗O2最多的是H2。
消耗32份质量的O2所需4种物质的相对质量分别为:24.8、4、32、12,所以相同质量的这4种物质消耗O2最多的是H2。



 点拨:这各方法我们称之为“归一法”,即假定某种物质的化学计量数为“1”,或假定每种物质各1g,写出化学方程式,便可计算比较出结果。
点拨:这各方法我们称之为“归一法”,即假定某种物质的化学计量数为“1”,或假定每种物质各1g,写出化学方程式,便可计算比较出结果。
2、


 A 解析:当氢与氧气完全反应时,生成18g水,由水的质量可以求出参加反应的氢气和氧气的的质量分别是2g和16g,即其质量比为1:8。
A 解析:当氢与氧气完全反应时,生成18g水,由水的质量可以求出参加反应的氢气和氧气的的质量分别是2g和16g,即其质量比为1:8。
1、


 C 解析:利用化学方程式可以计算出NH3和CO2的质量比为17 :44,列出比例式即可计算出生成4.4gCO2时,同时生成NH3的质量为1.7g。
C 解析:利用化学方程式可以计算出NH3和CO2的质量比为17 :44,列出比例式即可计算出生成4.4gCO2时,同时生成NH3的质量为1.7g。



 点拨:44是二氧化碳的相对分子质量,4.4是因为44的1/10,口算即可得出生成的氨气质量的数值为氨气相对分子质量17的1/10,即1.7g。在利用化学方程式的计算中,有很多类似的计算,利用其倍数关系,可快速得出答案。
点拨:44是二氧化碳的相对分子质量,4.4是因为44的1/10,口算即可得出生成的氨气质量的数值为氨气相对分子质量17的1/10,即1.7g。在利用化学方程式的计算中,有很多类似的计算,利用其倍数关系,可快速得出答案。
15、


 我国又迎来了一个航天高峰,继“神舟六号”宇宙飞船成功发射之后,“神舟七号”又发射在即。“神舟六号”携带了50kg的氧气,供宇航员呼吸之用,同时还有一套完整的系统用来吸收二氧化碳。有些宇宙飞船内是通过盛有氢氧化锂的过滤网来除去舱内所含的二氧化碳,反应的化学方程式如下:
我国又迎来了一个航天高峰,继“神舟六号”宇宙飞船成功发射之后,“神舟七号”又发射在即。“神舟六号”携带了50kg的氧气,供宇航员呼吸之用,同时还有一套完整的系统用来吸收二氧化碳。有些宇宙飞船内是通过盛有氢氧化锂的过滤网来除去舱内所含的二氧化碳,反应的化学方程式如下:



 2LiOH+CO2===
Li2CO3+H2O
2LiOH+CO2===
Li2CO3+H2O



 (1)试计算1g氢氧化锂所能吸收二氧化碳的质量。
(1)试计算1g氢氧化锂所能吸收二氧化碳的质量。



 (2)若用氢氧化钾来代替氢氧化锂,试计算1g氢氧化钾所能吸收的二氧化碳的质量。
(2)若用氢氧化钾来代替氢氧化锂,试计算1g氢氧化钾所能吸收的二氧化碳的质量。



 (反应的化学方程式为2KOH+CO2===K2CO2+H2O)
(反应的化学方程式为2KOH+CO2===K2CO2+H2O)



 (3)利用(1)和(2)所得的结果,试解释为什么宇宙飞船选用氢氧化锂来吸收二氧化碳比用氢氧化钾更好?
(3)利用(1)和(2)所得的结果,试解释为什么宇宙飞船选用氢氧化锂来吸收二氧化碳比用氢氧化钾更好?



 (4)若每位宇航员每天所呼出的二氧化碳平均是502:,现有4位宇航员在进行一项为期7天的太空任务,试计算在宇宙飞船上应携带氢氧化锂的质量。(在宇宙飞船内的温度和气压下,二氧化碳气体的密度为1.833g/L)
(4)若每位宇航员每天所呼出的二氧化碳平均是502:,现有4位宇航员在进行一项为期7天的太空任务,试计算在宇宙飞船上应携带氢氧化锂的质量。(在宇宙飞船内的温度和气压下,二氧化碳气体的密度为1.833g/L)











 紧跟教材训练答案
紧跟教材训练答案
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com