
题目列表(包括答案和解析)
8.

 请根据已有的知识解释下列现象:
请根据已有的知识解释下列现象:


 (1)被汗水浸湿的衣服晾干后会有白斑;晾干的咸菜表面有一层盐霜。
(1)被汗水浸湿的衣服晾干后会有白斑;晾干的咸菜表面有一层盐霜。


 (2)我国内蒙古地区的某些盐湖中,溶有较多的食盐和纯碱(碳酸钠)。生活在盐湖附近的人们冬天捞碱(即碳酸钠晶体)、夏天晒盐(食盐晶体)。
(2)我国内蒙古地区的某些盐湖中,溶有较多的食盐和纯碱(碳酸钠)。生活在盐湖附近的人们冬天捞碱(即碳酸钠晶体)、夏天晒盐(食盐晶体)。


 (3)将饱和的澄清石灰水升温与将CO2通入澄清石灰水后看到的现象有哪些相似,又有何区别?
(3)将饱和的澄清石灰水升温与将CO2通入澄清石灰水后看到的现象有哪些相似,又有何区别?


 答案
答案
7.

 怎样在家庭厨房的现有条件下,设法除去食盐中的泥沙?
怎样在家庭厨房的现有条件下,设法除去食盐中的泥沙?
6.

 现有两瓶失去标签的无色溶液:稀盐酸和氯化钠。某兴趣小组设计用化学方法和物理方法区分它们。(1)化学方法是_____________________________________;
现有两瓶失去标签的无色溶液:稀盐酸和氯化钠。某兴趣小组设计用化学方法和物理方法区分它们。(1)化学方法是_____________________________________;


 (2)物理方法 同学小王仅使用了酒精灯和玻璃棒两种仪器,就把这两种无色溶液区分开来了。请你猜测一下他的做法(简要叙述操作方法及判断方法)_______________。
(2)物理方法 同学小王仅使用了酒精灯和玻璃棒两种仪器,就把这两种无色溶液区分开来了。请你猜测一下他的做法(简要叙述操作方法及判断方法)_______________。


 (三)简答题:
(三)简答题:
5.

 一定温度下,向饱和澄清石灰水中加入少量氧化钙,充分反应后恢复到原来的温度,反应后的溶液与原饱和澄清石灰水相比,下列说法正确的是( )
一定温度下,向饱和澄清石灰水中加入少量氧化钙,充分反应后恢复到原来的温度,反应后的溶液与原饱和澄清石灰水相比,下列说法正确的是( )


 A、溶质的质量不变
B、溶质的质量减少
A、溶质的质量不变
B、溶质的质量减少


 C、溶质的质量分数变大
D、溶质的质量分数减小
C、溶质的质量分数变大
D、溶质的质量分数减小


 (二)填空题:
(二)填空题:
3.

 a、b、c三种物质的溶解度曲线如右图所示。现有t1℃时的a、b、c三种物质的饱和溶液,将其都升温至t2℃时,下列说法错误的是 ( )
a、b、c三种物质的溶解度曲线如右图所示。现有t1℃时的a、b、c三种物质的饱和溶液,将其都升温至t2℃时,下列说法错误的是 ( )



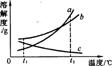 A.c溶液中有晶体析出
B.a、b溶液均为不饱和溶液
A.c溶液中有晶体析出
B.a、b溶液均为不饱和溶液


 C.c溶液中的溶质质量分数最小 D.a溶液中的溶质质量分数最大
C.c溶液中的溶质质量分数最小 D.a溶液中的溶质质量分数最大


 4.制豆腐最后一道工序是“点豆腐”(使豆浆变成块状豆腐)。
民间常用卤水(主要是氯化镁)或者石膏粉末点豆腐,若用石灰石代替石膏则起不到点豆腐的作用。以上事实表明( )
4.制豆腐最后一道工序是“点豆腐”(使豆浆变成块状豆腐)。
民间常用卤水(主要是氯化镁)或者石膏粉末点豆腐,若用石灰石代替石膏则起不到点豆腐的作用。以上事实表明( )


 A.石膏、石灰石均难溶
B.石膏微溶,石灰石难溶
A.石膏、石灰石均难溶
B.石膏微溶,石灰石难溶


 C.石膏难溶,石灰石微溶
D.石膏、石灰石均微溶
C.石膏难溶,石灰石微溶
D.石膏、石灰石均微溶
2.

 常温下有下列物质的饱和溶液各200克,分别加热到100℃时,并分别蒸发其中的少量水,一定会有晶体析出的是( )
常温下有下列物质的饱和溶液各200克,分别加热到100℃时,并分别蒸发其中的少量水,一定会有晶体析出的是( )


 A、澄清石灰水 B、硝酸钾的饱和溶液 C、饱和食盐水 D、蔗糖溶液
A、澄清石灰水 B、硝酸钾的饱和溶液 C、饱和食盐水 D、蔗糖溶液


 (一)选择题:
(一)选择题:
1.

 能证明澄清透明的矿泉水是混合物的实验是( )
能证明澄清透明的矿泉水是混合物的实验是( )


 A.取一滴矿泉水在显微镜下观察 B.在矿泉水中加石蕊试液
A.取一滴矿泉水在显微镜下观察 B.在矿泉水中加石蕊试液


 C.仔细品尝矿泉水的味道
D.取1-2滴矿泉水在玻璃片上蒸发
C.仔细品尝矿泉水的味道
D.取1-2滴矿泉水在玻璃片上蒸发
(一)


 选择题:
选择题:
1.

 2004年6月5日世界环境日的主题为“海洋存亡,匹夫有责”。下列说法错误的是( )
2004年6月5日世界环境日的主题为“海洋存亡,匹夫有责”。下列说法错误的是( )


 A.海水是混合物 B.海水是纯净物
A.海水是混合物 B.海水是纯净物


 C.海水是饱和溶液 D.海水晒盐的原理是蒸发溶剂得到晶体
C.海水是饱和溶液 D.海水晒盐的原理是蒸发溶剂得到晶体
2.

 下列物质可按溶解、过滤、蒸发的操作顺序,将它们分离开的是( )
下列物质可按溶解、过滤、蒸发的操作顺序,将它们分离开的是( )


 A、酒精和水 B、氯化钾和二氧化锰 C、氯化钠和硝酸钾 D、铁粉和铜粉
A、酒精和水 B、氯化钾和二氧化锰 C、氯化钠和硝酸钾 D、铁粉和铜粉
3.

 下列情况一定能使饱和溶液析出晶体的是( )
下列情况一定能使饱和溶液析出晶体的是( )


 A、升高温度
B、降低温度 C、加溶剂 D、蒸发溶剂
A、升高温度
B、降低温度 C、加溶剂 D、蒸发溶剂
4.

 将饱和的硝酸钾溶液降温至有晶体析出,在此过程中,没有发生变化的是( )
将饱和的硝酸钾溶液降温至有晶体析出,在此过程中,没有发生变化的是( )


 A、溶质质量
B、溶液质量 C、溶剂质量
D、溶解度
A、溶质质量
B、溶液质量 C、溶剂质量
D、溶解度
5.

 在“粗盐的提纯”实验中,下列仪器用到的次数最多的是 ( )
在“粗盐的提纯”实验中,下列仪器用到的次数最多的是 ( )


 A、漏斗
B、烧杯 C、玻璃棒 D、酒精灯
A、漏斗
B、烧杯 C、玻璃棒 D、酒精灯
6.


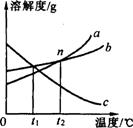 右图是a、b、c三种物质的溶解度曲线,下列说法正确的是( )
右图是a、b、c三种物质的溶解度曲线,下列说法正确的是( )


 A.a的溶解度大于b的溶解度
A.a的溶解度大于b的溶解度


 B.c一定是熟石灰的溶解度曲线
B.c一定是熟石灰的溶解度曲线


 C.三种物质的饱和溶液分别从t2 降温至t1℃,a、b析出的晶体质量相等
C.三种物质的饱和溶液分别从t2 降温至t1℃,a、b析出的晶体质量相等


 D.n点表示在t2℃时,a、b两种物质的饱和溶液溶质质量分数相同
D.n点表示在t2℃时,a、b两种物质的饱和溶液溶质质量分数相同
7.

 若将一定质量的硝酸钾不饱和溶液变为饱和溶液,则( )。
若将一定质量的硝酸钾不饱和溶液变为饱和溶液,则( )。


 (A)溶液的质量一定变小 (B)溶液中溶质的质量分数一定变大
(A)溶液的质量一定变小 (B)溶液中溶质的质量分数一定变大


 (C)溶液的质量一定变大 (D)溶液中溶质的质量分数可能不变
(C)溶液的质量一定变大 (D)溶液中溶质的质量分数可能不变


 (二)填空题:
(二)填空题:
8.


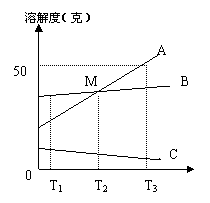 右图为A、B、C三种物质的溶解度曲线,由图可看出:
右图为A、B、C三种物质的溶解度曲线,由图可看出:


 (1)升高温度, 物质的不饱和的溶液
(1)升高温度, 物质的不饱和的溶液


 会变得饱和;
会变得饱和;


 (2)T3 ℃时,A 物质饱和溶液中溶质、溶剂与
(2)T3 ℃时,A 物质饱和溶液中溶质、溶剂与


 溶液的质量比为
;
溶液的质量比为
;



|


 的方法,而要将B从它的饱和溶液中
的方法,而要将B从它的饱和溶液中


 大量析出,只能采取
的方法;
大量析出,只能采取
的方法;


 (4)如果A中混有少量B,则经过
可以提纯A。
(4)如果A中混有少量B,则经过
可以提纯A。
3.

 常用的混合物分离的方法有三种:
常用的混合物分离的方法有三种:


 过滤是将可溶物与不溶物分离的方法,步骤有:溶解、过滤、蒸发结晶、洗涤干燥,如粗盐的提纯等。
过滤是将可溶物与不溶物分离的方法,步骤有:溶解、过滤、蒸发结晶、洗涤干燥,如粗盐的提纯等。


 结晶是将溶解度受温度变化影响不同的两种固体加以分离的方法。要使饱和溶液中的溶质大量结晶出来,对于溶解度受温度影响较大的物质,适宜用降温结晶法,反之,则适宜用蒸发结晶法。
结晶是将溶解度受温度变化影响不同的两种固体加以分离的方法。要使饱和溶液中的溶质大量结晶出来,对于溶解度受温度影响较大的物质,适宜用降温结晶法,反之,则适宜用蒸发结晶法。


 例如除去硝酸钾中混有的少量氯化钠,分离步骤为:①制成热饱和溶液;②冷却结晶(大量硝酸钾晶体析出);③过滤分离。
例如除去硝酸钾中混有的少量氯化钠,分离步骤为:①制成热饱和溶液;②冷却结晶(大量硝酸钾晶体析出);③过滤分离。


 例如除去氯化钠中混有的少量硝酸钾,分离步骤为:①制成溶液;②蒸发结晶(大量氯化钠晶体析出);③趁热过滤。
例如除去氯化钠中混有的少量硝酸钾,分离步骤为:①制成溶液;②蒸发结晶(大量氯化钠晶体析出);③趁热过滤。


 蒸馏是将沸点不同的两种液体加以分离的方法,如分离液态空气制氧气等。
蒸馏是将沸点不同的两种液体加以分离的方法,如分离液态空气制氧气等。


 典型例题:
典型例题:



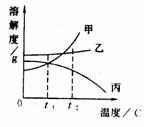 例1:下图是甲、乙、丙3种物质(均不含结晶水)的溶解度曲线。现有t2℃时甲、乙、丙3种物质的饱和溶液(无固体存在),请根据下图回答:
例1:下图是甲、乙、丙3种物质(均不含结晶水)的溶解度曲线。现有t2℃时甲、乙、丙3种物质的饱和溶液(无固体存在),请根据下图回答:


 (1)t2℃时,将3种饱和溶液分别恒温蒸发相同质量的水,析出晶体最多的是
。
(1)t2℃时,将3种饱和溶液分别恒温蒸发相同质量的水,析出晶体最多的是
。


 (2)将3种饱和溶液分别从t2℃降温到t1℃时,所得溶液中溶质的质量分数由大到小的顺序为
(2)将3种饱和溶液分别从t2℃降温到t1℃时,所得溶液中溶质的质量分数由大到小的顺序为


 解析:(1)t2℃时三种物质中甲的溶解度最大,即t2℃时,在相同量的水中甲物质溶解得最多,所以蒸发相同质量的水后甲析出量最多。
解析:(1)t2℃时三种物质中甲的溶解度最大,即t2℃时,在相同量的水中甲物质溶解得最多,所以蒸发相同质量的水后甲析出量最多。


 (2)由溶解度曲线可以看出,降温后甲、乙溶液中有晶体析出,仍然为饱和溶液,且乙的溶解度大于甲,所以乙溶液的溶质质量分数大于甲;丙物质降温后虽然溶解度升高,与甲相等了,但它此时为不饱和溶液,所以丙溶液的溶质质量分数小于甲。所以,溶液中溶质质量分数由大到小的顺序为乙>甲>丙。
(2)由溶解度曲线可以看出,降温后甲、乙溶液中有晶体析出,仍然为饱和溶液,且乙的溶解度大于甲,所以乙溶液的溶质质量分数大于甲;丙物质降温后虽然溶解度升高,与甲相等了,但它此时为不饱和溶液,所以丙溶液的溶质质量分数小于甲。所以,溶液中溶质质量分数由大到小的顺序为乙>甲>丙。


 注意:这里容易出现的错误是认为降温后丙溶液中溶质的质量分数与甲溶液中相等。导致此错误的原因是以为丙溶液中的溶质量也随着曲线上升了,而实际上,丙溶液中溶质的最多溶解量是增加了,但实际溶质量没有变,所以溶质的质量分数没变。
注意:这里容易出现的错误是认为降温后丙溶液中溶质的质量分数与甲溶液中相等。导致此错误的原因是以为丙溶液中的溶质量也随着曲线上升了,而实际上,丙溶液中溶质的最多溶解量是增加了,但实际溶质量没有变,所以溶质的质量分数没变。


 例2:(03天津市)在一定温度下,某固态溶质(不含结晶水)的水溶液甲,经历如下变化:
例2:(03天津市)在一定温度下,某固态溶质(不含结晶水)的水溶液甲,经历如下变化:


 溶液甲
溶液甲
 溶液乙
溶液乙  溶液丙,下列结论正确的是
溶液丙,下列结论正确的是


 A.溶液甲可能是饱和溶液
B.溶液乙一定是不饱和溶液 C.溶液乙和溶液丙中的溶质质量分数可能相等 D.溶液丙若再蒸发5 g水,析出的晶体的质量可能大于2 g
A.溶液甲可能是饱和溶液
B.溶液乙一定是不饱和溶液 C.溶液乙和溶液丙中的溶质质量分数可能相等 D.溶液丙若再蒸发5 g水,析出的晶体的质量可能大于2 g


 解析:甲蒸发5 g水无晶体析出,说明甲是不饱和溶液。乙继续蒸发5 g水析出2 g晶体,乙溶液可能饱和也可能不饱和。乙溶液如果饱和,则乙与丙溶液的溶质质量分数相等,反之则不等。如果乙溶液是在饱和的情况下蒸发5 g水析出2 g晶体的话,那么丙再蒸发5 g水,仍然应该再析出2 g 晶体,反之则应该大于2 g 。所以本题应该选择C、D。
解析:甲蒸发5 g水无晶体析出,说明甲是不饱和溶液。乙继续蒸发5 g水析出2 g晶体,乙溶液可能饱和也可能不饱和。乙溶液如果饱和,则乙与丙溶液的溶质质量分数相等,反之则不等。如果乙溶液是在饱和的情况下蒸发5 g水析出2 g晶体的话,那么丙再蒸发5 g水,仍然应该再析出2 g 晶体,反之则应该大于2 g 。所以本题应该选择C、D。
2.

 利用溶解度曲线,可以直观地选择混合物分离的方法。
利用溶解度曲线,可以直观地选择混合物分离的方法。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com