
题目列表(包括答案和解析)
1.0g/ cm3计。若测定中取用待测液25mL,标准液溶质的质量分数为4.5%,根据图中数据,计算待测液溶质的质量分数。(计算过程中数值保留至0.1)
亲爱的同学:题答好了吗?请别忘了再仔细检查一遍!祝你成功!
26.(7分) 利用中和反应可以测定酸或碱溶液中溶质的质量分数。例如,在一定量的待测酸(或碱)溶液中逐滴滴入已知质量分数的碱(或酸)溶液(这种溶液被称为标准溶液),直到酸、碱恰好完全反应,根据消耗标准碱(或酸)溶液的多少即可求算出待测酸(或碱)溶液的溶质质量分数。
右下图为某次测定过程中,溶液的pH随所滴加的某标准溶液体积的变化而变化的关系图。
(1)根据右下图曲线可以判断在实验中是向 (填“酸”或“碱”,下同)溶液(待测液)中滴加 溶液(标准液)。
(2)在这次测定中,为了指示中和反应刚好完全,用酚酞做指示剂,即在待测溶液中先滴入几滴酚酞试液,若看到 现象,则证明中和反应刚好完全。
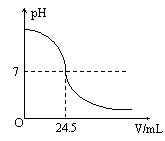 (3)如果实验中使用的酸是硫酸溶液,碱是氢氧化钠溶液,且待测液和标准液的密度均以
(3)如果实验中使用的酸是硫酸溶液,碱是氢氧化钠溶液,且待测液和标准液的密度均以
25. (3分) 在电缆生产过程中会产生一定量的含铜废料。据报道,在通入空气并加热的条件下,铜与稀硫酸反应转化为硫酸铜。
(3分) 在电缆生产过程中会产生一定量的含铜废料。据报道,在通入空气并加热的条件下,铜与稀硫酸反应转化为硫酸铜。
(1)请完成该反应的化学方程式。2Cu+2H2SO4+O2=======2CuSO4+
(2)若选用的稀硫酸溶质的质量分数为12%,则用100 mL98%的浓硫酸(密度为1.8g/cm3)配制该稀硫酸,需加水_________g。
(3)取一定量上述稀释后的硫酸(其中含溶质98g)与铜恰好完全反应,假定硫酸不和其他杂质反应,则反应后硫酸铜溶液的质量为(写出计算式即可)_______ _______________g。
|
方案 |
实验步骤 |
实验现象 |
|
1 |
取两个等体积的软塑料瓶,充满二氧化碳,然后 。 |
|
|
2 |
先将二氧化碳通入盛有足量氢氧化钠溶液的试管 中,然后 。 |
|
我认为方案1的探究方法是 ,
方案2的探究方法是 。
小结:上述三个实验告诉我们:当某些化学反应现象不明显或不足以说明问题时,要千方百计通过设计出具有明显现象的实验,来准确推知和认识化学反应。
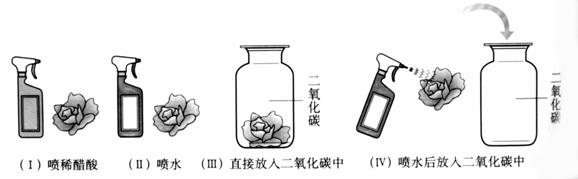
实验现象: (Ⅰ)、(Ⅳ)中的小花变红。
设计(Ⅱ)、(Ⅲ)实验的目的是: 。
该实验的探究方法是:设计分析 (填“A”或“B”或“C”),获得结论。
A.仅一个单因素的实验 B.有多种因素的对比实验 C.用前面实验的生成物继续实验
实验现象: 。
该实验的探究方法是:对看不见、摸不着的粒子,要“观察”它的运动可以设计实验,通过宏观的现象来间接认识。
24. (9分)经过一年的化学学习,我们亲身体验了一系列的探究实验,感受了化学的无穷魅力。小强在回顾整理下列实验中提炼了许多探究的方法。
(9分)经过一年的化学学习,我们亲身体验了一系列的探究实验,感受了化学的无穷魅力。小强在回顾整理下列实验中提炼了许多探究的方法。
23.(9分) 在实验台上摆放着如下仪器和药品:
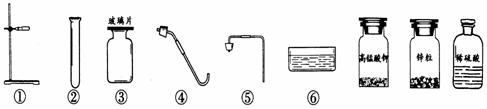
(1)根据提供的仪器和药品可以制取的气体是______________,发生反应的化学方程式为__________________________________________。
(2)利用以上仪器和药品制取该气体应选择的仪器为______________。(填编号)
(3)将纯净的该气体通入盛有氧化铜的试管中一段时间后加热,观察到的现象是________________________________________________________。
(4)利用提供的药品还可以制得初中学习过的另一种气体,但缺少的仪器是______________,反应的化学方程式为__________________________________。检验此种气体的方法是 。
22.(11分)有一包固体A,可能含有Cu(OH)2、CuO、Cu、NaOH、Na2CO3、CaCl2中的几种,取少量的A做如下实验,现象如图所示。
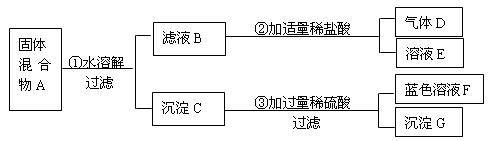
根据实验过程中的现象判断:
(1)气体D是 (填化学式,下同),沉淀G是 。
(2)混合物A中的可能组成有 、 、 。
(3)溶液F中,一定存在溶质是 。
(4)写出过程③中可能发生的化学反应中的一个化学方程式 。
(5)滤液B中,可能存在的溶质是 ,若要证明该物质是否存在,应补做实验是(写出主要实验步骤、现象及结论) 。
21.(9分) 按要求写出下列反应的化学方程式。
(1)红磷在氧气中燃烧
(2)铁棒插入硫酸铜溶液中
(3)一氧化碳与氧化铜反应
(4)硫酸铜溶液和氢氧化钠溶液反应
其中属于置换反应的是 。(填序号)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com