
题目列表(包括答案和解析)
6、
 某溶液由NaOH、稀HCl、稀H2SO4、和MgCl2中的一种或几种组成。向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液的体积的关系如右图所示。则该溶液中不可能存在的物质是(
),理由是( ) 。一定存在的物质是 ( )。
某溶液由NaOH、稀HCl、稀H2SO4、和MgCl2中的一种或几种组成。向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液的体积的关系如右图所示。则该溶液中不可能存在的物质是(
),理由是( ) 。一定存在的物质是 ( )。
[分析]:分析图像可知,向该溶液中刚加入Ba(OH)2溶液时,没有气体或沉淀生成,说明开始加入的Ba(OH)2优先与另一种物质反应且不产生沉淀,根据优先中和原理,该物质应为酸,但不能是H2SO4(因为H2SO4能与Ba(OH)2反应产生BaSO4沉淀),因而是稀HCl;又因为盐酸与NaOH不能共存,因而NaOH不存在。所以该溶液中不可能存在的物质是NaOH、稀H2SO4,一定存在的物质是稀HCl、MgCl2
5、向含AgNO3 、Cu(NO3)2、Zn(NO3)2的混合液中,加入一些铁粉,待反应完成后过滤,下列情况是可能存在的是( ) A.滤纸上有Ag,滤液中有Ag+、Cu2+、Zn2+、Fe2+ B.滤纸上有Ag 、Cu,滤液中有Ag+、Zn2+、Fe2+ C.滤纸上有Ag、Fe,滤液中有Zn2+、Fe2+ D.滤纸上有Ag、Zn、Fe,滤液中有Zn2+、Fe2+
[分析]:铁粉加入混合液中,可能发生的反应有:Fe+2AgNO3=Fe(NO3)2+2Ag ①;Fe+2Cu(NO3)2=Fe(NO3)2+Cu ②,根据溶液中的优先置换原理,反应①优先于反应②进行。因此,A选项中,滤液中有Ag+证明反应①未完成,自然反应②还未进行,正确;B选项中,滤纸上已经有Cu,说明反应②已经发生或已经完全发生,则反应①应完全反应,滤液中不可能有Ag+,不正确;C选项中,滤纸上有Fe,说明反应①②都已完全,但滤纸上没有Cu,不正确;D选项中,滤纸上由Zn,不正确。
4、 在盛有AgNO3和Cu(NO3)2混合溶液的试管中,加入一定量的锌粉充分反应,试管底部有少量固体存在。过滤,向滤液中加稀盐酸,产生白色沉淀,滤渣是( )
A. Cu B. Ag C. Zn和Ag D. Zn和Cu
[分析]:由于金属的金属活动性顺序是Cu>Ag,因而加入的锌粉优先与AgNO3反应,只有AgNO3完全反应后,锌粉才能与Cu(NO3)2反应,否则不反应。“向滤液中加稀盐酸,产生白色沉淀”说明溶液中的AgNO3尚未反应完,故Cu(NO3)2不可能反应,证明锌量不足,所以滤渣的成分应选B。
3. 在盛有AgNO3和Cu(NO3)2混合溶液的试管中,加入一定量的锌粉充分反应,试管底部有少量固体存在。过滤,向滤液中加稀盐酸,产生白色沉淀,滤渣是( )
A. Cu B. Ag C. Zn和Ag D. Zn和Cu
[分析]:由于金属的金属活动性顺序是Cu>Ag,因而加入的锌粉优先与AgNO3反应,只有AgNO3完全反应后,锌粉才能与Cu(NO3)2反应,否则不反应。“向滤液中加稀盐酸,产生白色沉淀”说明溶液中的AgNO3尚未反应完,故Cu(NO3)2不可能反应,证明锌量不足,所以滤渣的成分应选B。
2、下列各组物质恰好完全反应,所得溶液的颜色是无色的是( A 亚铁离子是绿色、铁离子是黄色,锌离子无色 )
A、锌和稀硫酸 B、铁和稀硫酸 C、铁和硫酸铜 D、铁和稀盐酸
1. 氧化银纽扣电池常用于手表和计算器,电池内的总反应可以表示为:
Zn+Ag2O=ZnO+2Ag,下列说法错误的是(D)
A.氧化银具有氧化性 B.锌发生了氧化反应
C.氧化银发生了还原反应 D.在反应中锌元素的化合价降低
7、李红想把一枚生锈的铜币“复原”。她找来了废电池的锌皮和试剂A,设计了如下实验方案。

试回答:
(1)操作a为 ,所加试剂A可能为 。(填化学式)
(2)进行反应Ⅱ、Ⅲ需用到的装置是 。(填序号)
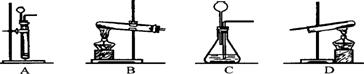
(3)反应Ⅲ的化学方程式是 。在该实验中,通入气体B之前应先 ,以防危险发生。
(4)李红观察到黑铜币刚变成光亮时,便停止通入气体B。则她的“复原”实验
(填“能”或“不能”)达到最终目的。
(5)欲使铜币“复原”还有许多方法,请你再设计一个方案。(文字叙述或用化学方程式表示)
6.钛(Ti)因为具有许多神奇的性能而越来越引起人们的关注。某化学兴趣小组对Mg、Ti、Ag的金属活动性顺序进行探究。提出假设:a.Ti的金属活动性比Mg强;b.Ti的金属活动性介于Mg和Ag之间。
查阅资料:在相同条件下,金属与酸反应,产生气泡的速度越快,则该金属活动性越强。
实验设计:同温下,取大小相同的这三种金属薄片,分别投入等体积、等质量分数的足量稀盐酸中,观察现象。
请回答:
(1)三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是 (填序号)
①除去氧化膜,利于直接反应②使反应的金属温度相同,易反应 ③使表面光亮,易观察现象
(2)根据下表中的实验现象填空:
|
|
Ti |
Mg |
Ag |
|
实验现象 |
产生气泡速度缓慢 |
产生气泡速度快 |
无任何现象 |
结论:原假设中 不正确(填“a”或“b”或“ab”),理由是 ;三种金属的活动性由强到弱的顺序为 .
(3)上述实验设计中,如果所用盐酸的溶质质量分数不同,是否一定能够得出正确的结论? (填“是”或“否”),理由是 。
5.等质量的镁和锌分别放置在两只烧杯中,向其中分别逐滴加入质量分数相等的稀硫酸到过量,下图正确的是


4. 如图表示等质量的金属Mg和Al分别与足量且质量分数相等的稀硫酸反应,下列叙述正确的是
如图表示等质量的金属Mg和Al分别与足量且质量分数相等的稀硫酸反应,下列叙述正确的是
A、X表示反应所用时间,Y表示生成氢气的质量
B、X表示生成氢气的质量,Y表示反应所用时间
C、X表示滴加稀硫酸的质量,Y表示生成氢气的质量
D、X表示参加反应的金属的质量,Y表示生成氢气的质量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com