
题目列表(包括答案和解析)
30.(5分)某学生在课外活动中用一定量的二价金属R和稀硫酸反应来制取氢气,所做5次实验结果记录如下表(假设每次实验所产生的氢气全部被收集,体积在同温同压下测定)。
|
实验编号 |
R 的质量/克 |
稀硫酸的体积/毫升 |
生成H2的体积/升 |
|
1 |
1.5 |
50.0 |
1.47 |
|
2 |
2.0 |
50.0 |
1.96 |
|
3 |
2.2 |
50.0 |
2.16 |
|
4 |
2.5 |
50.0 |
2.16 |
|
5 |
3.0 |
50.0 |
2.16 |
根据上述实验结果进行分析、计算,并回答下列问题:
(1)上述实验中,金属一定过量的组的编号是 ,稀硫酸一定过量的组的编号是 。
(2)若在当时实验条件下,H2的密度为0.085克/升,则反应所用金属R的相对原子质量为 。
(3)若所使用的稀硫酸密度为1.12克/厘米3,则反应所用的硫酸溶液中溶质的质量分数为 。
|
食 品名 称 |
500g食品的味精 含量/mg |
|
春 卷 |
400 |
|
排 骨 |
240 |
|
水 饺 |
130 |
29.(3分)酒楼的食品在制作时常加入味精,味精是一种有机化合物一谷氨酸钠,其化学式为C5H8NO4Na。右表为某酒楼常见食品中味精的含量,根据题中的信息计算:(列式计算)
⑴ 谷氨酸钠的相对分子质量为 ;其中碳、氢元素的质量比为 ;
⑵ 若某同学一次吃了200g春卷,他食用了 mg味精,其中含钠元素的质量为 mg(结果保留一位小数)。
28.(8分)Fe(OH)3是一种红褐色沉淀,Fe(OH)2却是一种白色沉淀,它们都可以在水中通过发生复分解反应来制得。由于Fe(OH)2不稳定,在水中,只要有一点氧气就极易发生反应生成Fe(OH)3,写出其反应的化学方程式: ,因而在溶液中较难制得纯净的Fe(OH)2 。若按照常规方法向FeCl2溶液中滴加NaOH溶液,较难观察到白色沉淀现象。
用下面两种精心设计的方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含氧气的蒸馏水配置FeSO4溶液与氢氧化钠溶液,然后反应制备。
⑴除去蒸馏水中溶解的氧气,常采用 的方法。
⑵先在试管中注入FeSO4溶液后,还要在试管中滴入 来隔绝空气,然后再考虑加入NaOH溶液,实验更容易获得成功。
 ⑶生成白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是
。
⑶生成白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是
。
方法二:用右图装置来制备。
⑴在装置Ι中加入Fe和稀H2SO4 , ⑵在装置Ⅱ中加入NaOH浓溶液。
⑶为了制得白色Fe(OH)2沉淀,在装置Ι和Ⅱ中加入试剂,打开止水夹,塞紧橡胶塞,反应一段时间后再夹紧止水夹,在夹紧止水夹之前的实验步骤是 , 写出夹紧止水夹后Ⅱ中的反应方程式 、 。
⑷这样生成的Fe(OH)2沉淀能较长时间保持白色,其原因是 。
27.(6分)某化学科技活动小组的同学学过氨气后,查阅资料发现氨气一种密度比空气小、且极易溶于水的气体,在常温下遇到HCl气体,会产生大量白烟,白烟的主要成分是这两种气体化合形成的铵盐M的固体小颗粒。带着极大的兴趣,小组的同学想先制取干燥的氨气,然后利用它来探究与HCl气体的反应。经过小组讨论,他们设计了如下的实验装置:
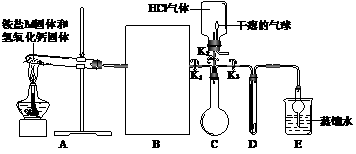

图1 图2
注:整套装置的气密性良好(且图1中的B和C装置还不完善,有待于同学们在实验过程中选择和补充),D装置的试管内有一张湿润的红色石蕊试纸;E装置的作用是吸收反应产生的剩余氨气,防止其进入空气,造成污染;碱石灰固体是氢氧化钠固体和生石灰固体的混合物。
(1)请你参与小组的探究:
|
实验目的 |
实验操作及现象 |
|
制取一烧瓶干燥的氨气 |
①按图1装配仪器和试剂,其中图1方框内的B装置应选择图2中的______(填序号);请在C装置的烧瓶内画出连接止水夹K1和K3的导管长度情况。 ②打开止水夹K1和K3,关闭止水夹K2,点燃酒精灯加热,当出现__________________________现象时,停止加热,并关闭止水夹K1和K3。 |
|
探究氨气与HCl气体的反应 |
③打开止水夹K2,一段时间后,除了看到有大量白烟生成这一现象外,还可观察到______________________________,导致这一现象的主要原因是_________。 |
(2)氯化氢气体与氨气发生化合反应,生成一种铵盐,写出反应的化学方程式:
26.(4分)已知A~J这10种物质是初中化学中常见的物质,其中A是一种黑色固体,B可做建筑材料,下图是这些物质间的转化关系图,试回答:

(1) D物质的化学式为 。H溶液的颜色是 。
(2)写出反应①、③的化学方程式 ; 。
25.(5分)实验室废水任意排放会造成环境污染。某校实验室中的废水中含有大量的
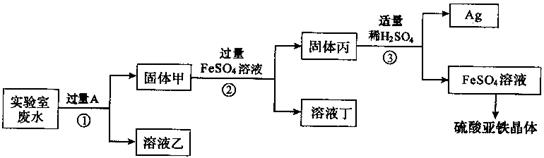 AgNO3、Zn(NO3)2、Fe(NO3)2,该校实验小组拟从该废水中回收银,并得到副产品硫酸亚铁晶体。实验方案如下所示(实验过程中未引入其它的金属元素)
AgNO3、Zn(NO3)2、Fe(NO3)2,该校实验小组拟从该废水中回收银,并得到副产品硫酸亚铁晶体。实验方案如下所示(实验过程中未引入其它的金属元素)
(1)实验室常用 的方法分离固体甲和溶液乙,该操作需要使用的仪器有 。
(2)固体甲中含有的物质是(填化学式) 。
(3)步骤①向废水中加入过量的A。检验A是否过量的方法是
。
24.(5分)2009年世界环境日的中国主题发布,即“减少污染--行动起来”。
(1)有人认为,天然气作燃料可避免温室效应的发生。对此说法你的评价是
。请写出天然气燃烧的化学方程式: 。
(2)为了防止燃气泄露,常在燃气中加入少量有特殊气味的乙硫醇(C2H5SH)。一旦燃气泄露即可闻到气味,乙硫醇充分燃烧时产生二氧化碳、二氧化硫和水,燃烧的化学方程式为 。
(3)煤燃烧时会排放出 等气体污染物,这些气体或气体在空气中反应后的生成物溶于水,会形成酸雨。酸雨会对植物、 等造成严重危害。
23.(6分)(1)化学与我们的生活息息相关。请从:A.碳酸钠B. 氯化钠C.氢氧化钠D.碳酸氢钠E.水 F.酒精G. 石油H..煤 等八种物质中选择适当的字母序号填空:
①治疗胃酸过多的药剂是 ②被誉为“工业的血液”的是
③候德榜联合制碱法中的“碱” ④最常见的溶剂是
(2)物质的组成与结构决定物质的性质。试分析导致下列两组物质性质不同的原因。
①氢氧化钠和氢氧化钡溶液都能使无色酚酞试液变红。原因是 。;
②金刚石很硬,而石墨却很软。原因是 。
22.(5分)钢铁是重要的金属材料。
 ⑴下列铁制品中,制造铁丝利用了铁的性质是______________。
⑴下列铁制品中,制造铁丝利用了铁的性质是______________。
⑵目前世界上已有50%以上的废钢铁得到回收利用,其目的是 。
A. 节约金属资源 B. 合理开采矿物 C. 防止钢铁生锈
⑶为防止水龙头生锈,其表面镀有一层铬。铁生锈的条件是___________________。
⑷将生锈的铁制品放入盛有过量稀盐酸的洗槽中,观察到溶液变黄,有无色气泡逸出。写出其中一个反应的化学方程式____________________________________。
(5)铁锅有生铁铸造的,有不锈钢制造的,生铁和钢物理、机械性能有较大差异,产生差异的原因是 。
21. (8分)请你结合下列装置图和题中信息回答问题:
(8分)请你结合下列装置图和题中信息回答问题:


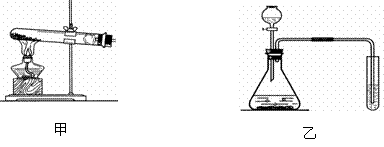
(1)实验室用甲装置制氧气的化学方程式是______________________________ 。反应完全后冷却,往试管中加入足量的水,搅拌、过滤,得到黑色粉末。该黑色粉末与过氧化氢接触有大量气泡产生,反应的化学方程式是____________________________________。
(2)某化学兴趣小组用乙装置制取并检验二氧化碳。实验过程中,可观察到试管里产生____________色沉淀,反应的化学方程式是________________________ 。产生沉淀后继续通入二氧化碳,过一段时间后,发现沉淀溶解变成澄清溶液。为了确定沉淀溶解成澄清溶液的原因,该小组的同学进行了相关探究。
[ 提出问题 ] 沉淀为什么能溶解变成澄清溶液?
[ 查阅资料 ] 碳酸钙溶于酸,碳酸氢钙[Ca(HCO3)2]溶于水。
[ 猜想与假设 ] ①溶液呈酸性;②反应生成了碳酸氢钙。
[ 实验与结论 ]
|
实验操作 |
实验现象 |
实验结论 |
|
实验Ⅰ:
|
测得被测液的pH=8 |
猜想①______________。 (填“成立”或“不成立”) |
|
实验Ⅱ:取沉淀溶解后的澄清溶液于另一支试管中,加入______________________。 |
有气体产生 |
反应的化学方程式为: _____________________________。 猜想②成立。 |
通过探究得知,生成的沉淀会与二氧化碳、水反应生成了可溶于水的碳酸氢钙。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com