
题目列表(包括答案和解析)
8.

 (09年湖北恩施州)1. 元素周期表是学习化学的重要工具。下面是元素周期表中1~18号元素原子核外电子排
(09年湖北恩施州)1. 元素周期表是学习化学的重要工具。下面是元素周期表中1~18号元素原子核外电子排


 布,我们对它进行研究:
布,我们对它进行研究:



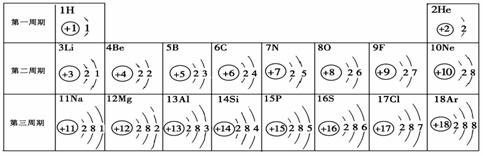























 ⑴ 第16号元素属于_______元素(填“金属”或“非金属”),它在化学反应中容易________(填“得”或“失”)电子;
⑴ 第16号元素属于_______元素(填“金属”或“非金属”),它在化学反应中容易________(填“得”或“失”)电子;


 ⑵ 元素的化学性质与原子结构中的______________数关系密切;
⑵ 元素的化学性质与原子结构中的______________数关系密切;


 ⑶ 在同一族中,各元素的原子结构呈现的规律有________________
(任写一点);
⑶ 在同一族中,各元素的原子结构呈现的规律有________________
(任写一点);


 ⑷ 研究表明:第二周期从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小。我分析第三周期从11~17号元素原子半径变化规律是
_________________________________。
⑷ 研究表明:第二周期从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小。我分析第三周期从11~17号元素原子半径变化规律是
_________________________________。


 关键词: 元素周期表 电子排布图
关键词: 元素周期表 电子排布图


 答案:⑴
非金属 ;得 ;
答案:⑴
非金属 ;得 ;


 ⑵ 最外层电子 ;
⑵ 最外层电子 ;


 ⑶ 电子层数递增或最外层电子数相等或从上到下核电荷数增大等(只要合理均可)⑷
逐渐减小
⑶ 电子层数递增或最外层电子数相等或从上到下核电荷数增大等(只要合理均可)⑷
逐渐减小










7.

 (09山东烟台)某元素的原子结构示意图如下,对该元素的有关认识正确的是
(09山东烟台)某元素的原子结构示意图如下,对该元素的有关认识正确的是



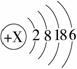 (A)该元素的原子核内质子数是34
(A)该元素的原子核内质子数是34


 (B)该元素是金属元素
(B)该元素是金属元素


 (C)该元素原子的最外层电子数是2
(C)该元素原子的最外层电子数是2


 (D)该元素位于元素周期表中的第四周期
(D)该元素位于元素周期表中的第四周期


 关键词: 原子的概念 元素周期表 原子核外电子排布
关键词: 原子的概念 元素周期表 原子核外电子排布


 答案: A、D
答案: A、D
6.

 (09江苏省连云港)35.右图为元素周期表中钠元素的相关信息,下列说法正确的是( )
(09江苏省连云港)35.右图为元素周期表中钠元素的相关信息,下列说法正确的是( )



 A.钠原子核内质子数为11
A.钠原子核内质子数为11


 B.钠为非金属元素
B.钠为非金属元素



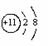 C.钠原子的实际质量为22.99 g
C.钠原子的实际质量为22.99 g


 D.钠元素的原子结构示意图为
D.钠元素的原子结构示意图为


 关键词:元素周期表单元格内容的含义
关键词:元素周期表单元格内容的含义


 答 案:A
答 案:A
5.

 (09辽宁锦州)下列粒子,在化学反应中易形成阳离子的是( )
(09辽宁锦州)下列粒子,在化学反应中易形成阳离子的是( )



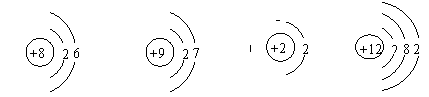



 A
B
C
D
A
B
C
D


 关键词:阳离子
关键词:阳离子


 答 案:D
答 案:D
4.

 D解析:金属钠在氯气中燃烧,每个钠原子失去1个电子形成带正电荷的钠离子(Na+),每个氯原子得到1个电子形成带负电荷的氯离子(Cl-),故A正确;在化学反应中,分子先分解成原子,所以B正确,氯化钠形成的过程是钠失电子氯得电子的过程,所以在化学反应中核外电子起着重要的作用,故C正确,氯化钠是离子化合物,所以是由离子构成的,故D错。
D解析:金属钠在氯气中燃烧,每个钠原子失去1个电子形成带正电荷的钠离子(Na+),每个氯原子得到1个电子形成带负电荷的氯离子(Cl-),故A正确;在化学反应中,分子先分解成原子,所以B正确,氯化钠形成的过程是钠失电子氯得电子的过程,所以在化学反应中核外电子起着重要的作用,故C正确,氯化钠是离子化合物,所以是由离子构成的,故D错。
4.


 (2008·河南)下图是钠与氯气(Cl2)反应生成氯化钠的模拟图。从图示可知下列说法不正确的是( )
(2008·河南)下图是钠与氯气(Cl2)反应生成氯化钠的模拟图。从图示可知下列说法不正确的是( )






 A.反应中钠原子转移一个电子给氯原子
A.反应中钠原子转移一个电子给氯原子


 B. 反应中氯气分子分成氯原子
B. 反应中氯气分子分成氯原子


 C. 核外电子在化学反应中起着重要作用
C. 核外电子在化学反应中起着重要作用


 D. 氯化钠由氯化钠分子构成
D. 氯化钠由氯化钠分子构成
3.

 下列说法错误的是
下列说法错误的是


 A.阳离子一定带有正电荷
A.阳离子一定带有正电荷


 B.带电荷的原子团一定是酸根
B.带电荷的原子团一定是酸根


 C.具有相同质子数的粒子不一定是同一种元素
C.具有相同质子数的粒子不一定是同一种元素


 D.最外层电子数为8的粒子不一定是稀有气体元素的原子
D.最外层电子数为8的粒子不一定是稀有气体元素的原子


 关键词: 元素、离子
关键词: 元素、离子


 答案:B
答案:B
2.

 若R元素的一种粒子的结构示意图为
若R元素的一种粒子的结构示意图为 ,则下列说法中正确的是
,则下列说法中正确的是


 A.该粒子的核外有2个电子层 B.R元素是金属元素
A.该粒子的核外有2个电子层 B.R元素是金属元素


 C.该粒子是阳离子
D.该粒子的最外层有8个电子
C.该粒子是阳离子
D.该粒子的最外层有8个电子



 关键词:元素周期表
关键词:元素周期表


 答案:A
答案:A
1.

 (09,广州)下列原子属于金属元素的是( )
(09,广州)下列原子属于金属元素的是( )



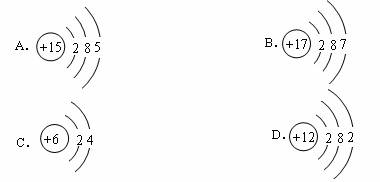





























 关键词:微粒的结构 元素
关键词:微粒的结构 元素


 答案:D
答案:D
15、
 为测定空气中氧气的含量,小华同学打算设计如下方案:选用实际容积为40 mL的试管作反应容器,将过量的白磷放入试管,用橡皮塞塞紧试管,通过导管与实际容积为60 mL且润滑性很好的针筒注射器组成如下图的实验装置。假设此实验能够按照小华的设想正常进行,且白磷所占体积与导管内的气体体积忽略不计,请回答下列问题:
为测定空气中氧气的含量,小华同学打算设计如下方案:选用实际容积为40 mL的试管作反应容器,将过量的白磷放入试管,用橡皮塞塞紧试管,通过导管与实际容积为60 mL且润滑性很好的针筒注射器组成如下图的实验装置。假设此实验能够按照小华的设想正常进行,且白磷所占体积与导管内的气体体积忽略不计,请回答下列问题:


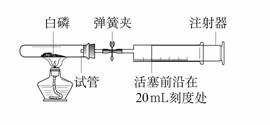 (1)实验前,打开弹簧夹,将注射器活塞前沿从20 mL刻度处推至15 mL刻度处,然后松开手,若活塞仍能返回至20 mL刻度处,则说明
;
(1)实验前,打开弹簧夹,将注射器活塞前沿从20 mL刻度处推至15 mL刻度处,然后松开手,若活塞仍能返回至20 mL刻度处,则说明
;

 (2)若先夹紧弹簧夹,用酒精灯加热白磷,燃烧结束,等到试管冷却后再松开弹簧夹。可观察到的现象为
;
(2)若先夹紧弹簧夹,用酒精灯加热白磷,燃烧结束,等到试管冷却后再松开弹簧夹。可观察到的现象为
;

 (3)若不使用弹簧夹,用酒精灯加热白磷,充分反应直至燃烧结束,试管冷却。可观察到的现象为_________________________________________________________ ;
(3)若不使用弹簧夹,用酒精灯加热白磷,充分反应直至燃烧结束,试管冷却。可观察到的现象为_________________________________________________________ ;

 (4)若按小华的设想进行实验,实际可能遇到诸多问题而发生危险,造成实验失败。例如:____________________________________________________________ 。
(4)若按小华的设想进行实验,实际可能遇到诸多问题而发生危险,造成实验失败。例如:____________________________________________________________ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com