
题目列表(包括答案和解析)
14.下列说法中正确的是
A.在一房间内,打开一台冰箱的门,再接通电源,过一段时间后,室内温度就会降低
B.从目前的理论看来,只要实验设备足够高级,可以使温度降低到-274℃
C.第二类永动机不能制造出来,尽管它不违反热力学第一定律,但它违反热力学第二定律
D.机械能可以自发地全部转化为内能,内能也可以全部转化为机械能而不引起其他变化
15.某同学采用如图所示的装置来研究光电效应现象.当用某单色光照射光电管的阴极K时,会发生光电效应现象.闭合开关S,在阳极A和阴极K之间加上反向电压,通过调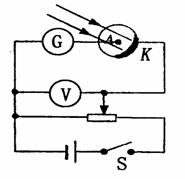 节滑动变阻器的滑片逐渐增大电压,直至电流计中电流恰好为零,此时电压表电压值U称为反向截止电压.现分别用频率为v1和v2的单色光照射阴极,测量到反向截止电压分别为U1和U2,设电子质量为m,电荷量为e,普朗克常数为h,则下列关系式中不正确的是
节滑动变阻器的滑片逐渐增大电压,直至电流计中电流恰好为零,此时电压表电压值U称为反向截止电压.现分别用频率为v1和v2的单色光照射阴极,测量到反向截止电压分别为U1和U2,设电子质量为m,电荷量为e,普朗克常数为h,则下列关系式中不正确的是
A.频率为v1的光照射时,光电子的最大初速度vm=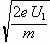
B.阴极K金属的逸出功W=h v2-e U2
C.阴极K金属的极限频率v0=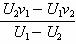
D.普朗克常数h=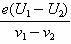
16.气象卫星是用来拍摄云层照片、观测气象资料和测量气象数据的.我国先后自行成功研制和发射了“风云一号”和“风云二号”两颗气象卫星.“风云”一号卫星轨道与赤道平面垂直并且通过两极,每12 h巡视地球一周,称为“极地圆轨道”.“风云二号”气象卫星轨道平面在赤道平面内称为“地球同步轨道”,则“风云一号”卫星比“风云二号”卫星
A.发射速度大 B.线速度小 C.覆盖地面区域大 D.向心加速度大
17.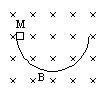 如下图,在竖直平面内放一个光滑绝缘的半圆形轨道,水平方向的匀强磁场与半圆形轨道所在的平面垂直.一个带正电荷的小滑块由静止开始从半圆轨道的最高点M滑下,则下列说法中正确的是
如下图,在竖直平面内放一个光滑绝缘的半圆形轨道,水平方向的匀强磁场与半圆形轨道所在的平面垂直.一个带正电荷的小滑块由静止开始从半圆轨道的最高点M滑下,则下列说法中正确的是
A.滑块经过最低点时的速度比磁场不存在时大
B.滑块从M点到最低点所用的时间比磁场不存在时短
C.滑块经过最低点时的速度与磁场不存在时相等
D.滑块从M点滑到最低点所用的时间与磁场不存在时相等
18. 如图所示,水平放置的平行板电容器,两板间距为d,带负电的小球质量为m,带电量为q,它从下极板N的小孔P中,以初速度v0射入,沿直线到达上板M上的小孔Q,若重力加速度为g.则
如图所示,水平放置的平行板电容器,两板间距为d,带负电的小球质量为m,带电量为q,它从下极板N的小孔P中,以初速度v0射入,沿直线到达上板M上的小孔Q,若重力加速度为g.则
A.小球在M、N间运动加速度可能为零
B .M板电势低于N板电势
C.小球从P到Q,电势能增加了mgd
D.M、N间电势差大小为mgd/q
19.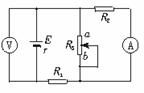 在如图所示的电路中,R1、R2为定值电阻,R3为可变电阻,电源的电动势为E,内阻为r .设电流表A的读数为I,电压表V的读数为U .当R3滑动触片向图中a端移动,则
在如图所示的电路中,R1、R2为定值电阻,R3为可变电阻,电源的电动势为E,内阻为r .设电流表A的读数为I,电压表V的读数为U .当R3滑动触片向图中a端移动,则
A.I变大,U变小 B.I变大,U变大
C.I变小,U变大 D.I变小,U变小
20.如图是一列简谐横波t=0时刻的一部分波动图象,波沿x轴正方向传播,波速v=20 m/s.则t=1.25 s时刻,图中横坐标为40 m的P质点所在处的位置坐标为
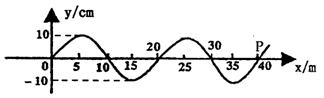 A.(65,0)
A.(65,0)
B.(65,10)
C.(40,10)
D.(40,-10)
21.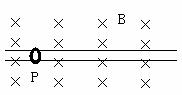 如图所示,质量为m,电荷量为q的P环在水平放置的足够长的固定粗糙杆上,整个装置放在磁感应强度为B的匀强磁场中,现给P环一个水平向右的瞬时冲量I,使环开始运动,则P环运动后
如图所示,质量为m,电荷量为q的P环在水平放置的足够长的固定粗糙杆上,整个装置放在磁感应强度为B的匀强磁场中,现给P环一个水平向右的瞬时冲量I,使环开始运动,则P环运动后
A.P环克服摩擦力做的功可能大于零而小于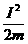
B. P环克服摩擦力做的功可能为零
C.P环克服摩擦力做的功一定为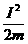
D.P环最终所受的合外力不一定为零
第二卷(非选择题 共174分)
22.(17分)(Ⅰ)如图是用双缝干涉测光的波长的实验设备示意图。
⑴下图中①是光源,⑤是光屏,它们之间的④是______。
⑵以下哪些操作能够增大光屏上相邻两条亮纹之间的距离_________(填字母)
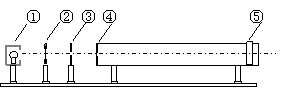 A.增大③和④之间的距离
A.增大③和④之间的距离
B.增大④和⑤之间的距离
C.将红色滤光片改为绿色滤光片
D.增大双缝之间的距离
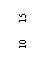
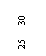
 ⑶在某次实验中,已知双缝到光屏之间的距离是600mm,双缝之间的距离是0.20mm,单缝到双缝之间的距离是100mm,某同学在用测量头测量时,先将测量头目镜中看到的分划板中心刻线对准某条亮纹(记作第1条)的中心,这时手轮上的示数如左图a所示。然后他转动测量头,使分划板中心刻线对准第7条亮纹的中心,这时手轮上的示数如右图b所示,图b示数为______mm。由此可以计算出这次实验中所测得的单色光的波长为_______nm(保留二位有效数字)。
⑶在某次实验中,已知双缝到光屏之间的距离是600mm,双缝之间的距离是0.20mm,单缝到双缝之间的距离是100mm,某同学在用测量头测量时,先将测量头目镜中看到的分划板中心刻线对准某条亮纹(记作第1条)的中心,这时手轮上的示数如左图a所示。然后他转动测量头,使分划板中心刻线对准第7条亮纹的中心,这时手轮上的示数如右图b所示,图b示数为______mm。由此可以计算出这次实验中所测得的单色光的波长为_______nm(保留二位有效数字)。
(Ⅱ)将满偏电流Ig=300μA、内阻未知的电流表G改装成电压表。
 (1)利用如图所示的电路测量电流表G的内阻(图中电源的电动势E=4V ):先闭合S1,调节R,使电流表指针偏转到满刻度;再闭合S2,保持R不变,调节R′,使电流表指针偏转到满刻度的
(1)利用如图所示的电路测量电流表G的内阻(图中电源的电动势E=4V ):先闭合S1,调节R,使电流表指针偏转到满刻度;再闭合S2,保持R不变,调节R′,使电流表指针偏转到满刻度的 ,读出此时R′的阻值为200Ω,则电流表内阻的测量值Rg=
Ω.
,读出此时R′的阻值为200Ω,则电流表内阻的测量值Rg=
Ω.
(2)将该表改装成量程为3V的电压表,需 ____(填“串联”或“并联”)阻值为R0= Ω的电阻.
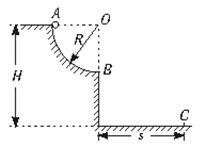
23.(16分)如图所示,位于竖直平面上的1/4圆弧光滑轨道,半径为R,OB沿竖直方向,上端A距地面高度为H,质量为m的小球从A点由静止释放,最后落在水平地面上C点处,不计空气阻力,求:
(1)小球运动到轨道上的B点时,对轨道的压力多大?
(2)小球落地点C与B点水平距离s是多少?
24.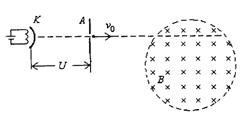 (19分)如图所示,涂有特殊材料的阴极K,在灯丝加热时会逸出电子,电子的初速度可视为零,质量为m、电量为e.逸出的电子经过加速电压为U的电场加速后,射入与磁场方向垂直的半径为R的圆形匀强磁场区域.已知磁场的磁感强度为B,方向垂直纸面向里,电子在磁场中运动的轨道半径大于R。试求:
(1)电子进入磁场时的速度大小;
(19分)如图所示,涂有特殊材料的阴极K,在灯丝加热时会逸出电子,电子的初速度可视为零,质量为m、电量为e.逸出的电子经过加速电压为U的电场加速后,射入与磁场方向垂直的半径为R的圆形匀强磁场区域.已知磁场的磁感强度为B,方向垂直纸面向里,电子在磁场中运动的轨道半径大于R。试求:
(1)电子进入磁场时的速度大小;
(2)电子在磁场中运动轨迹的半径r的大小; (3)电子从圆形磁场区边界的入射位置不同,它在磁场区内运动的时间就不相同.求电子在磁场区内运动时间的最大值.
25.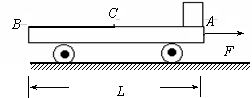 (20分)如图所示,光滑水平地面上停着一辆平板车,其质量为2m,长为L,车右端(A点)有一块静止的质量为m的小金属块.金属块与车间有摩擦,与中点C为界, AC段与CB段动摩擦因数不同.现给车施加一个向右的水平恒力,使车向右运动,同时金属块在车上开始滑动,当金属块滑到中点C时,即撤去这个力.已知撤去力的瞬间,金属块的速度为v0,车的速度为2v0,最后金属块恰停在车的左端(B点)。求:
(20分)如图所示,光滑水平地面上停着一辆平板车,其质量为2m,长为L,车右端(A点)有一块静止的质量为m的小金属块.金属块与车间有摩擦,与中点C为界, AC段与CB段动摩擦因数不同.现给车施加一个向右的水平恒力,使车向右运动,同时金属块在车上开始滑动,当金属块滑到中点C时,即撤去这个力.已知撤去力的瞬间,金属块的速度为v0,车的速度为2v0,最后金属块恰停在车的左端(B点)。求:
(1)拉力作用的时间t1和拉力F的大小?
(2)车最后匀速时的速度?
(3)金属块与CB段间的动摩擦因数µ2=?
26.(16分)下表是短周期中部分元素的原子半径及主要化合价。
|
元素代号 |
U |
V |
W |
X |
Y |
Z |
|
原子半径/nm |
0.037 |
0.157 |
0.066 |
0.070 |
0.077 |
0.143 |
|
主要化合价 |
+1 |
+1 |
-2 |
-3,+5 |
+2,+4 |
+3 |
请回答:
(1)Y在元素周期表中的位置是 ,镁条在盛有YW2气体的集气瓶中燃烧的现象为 。
(2)V、W、Z三种元素的离子具有相同的电子层结构,三者的离子半径由大到小顺序是
(用元素符号表示)。
并用离子方程式表示出Z离子可作净水剂的原因
(3)W、X、Y分别与U可形成10电子共价化合物,三者均可形成 晶体,其中沸点最高的是(写化学式)__ ;1g YU4气体完全燃烧生成液态水时,放出a kJ的热量,则该反应的热化学方程式为 。
(4)现有Z与V2W2的固体混合物样品,加入稀盐酸至混合物完全溶解,所得的混合液中c(Z3+)︰c(H+)︰c(Cl-)=1︰2︰8,则原固体混合物中,Z元素与W元素的质量比为
(最简整数比)。
27.(15分)已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)
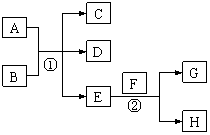
请回答下列问题:
(1)请写出反应②的化学方程式 ,当生成2.24L的G(标准状况)时,此时反应转移的电子数目为
(2)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出稀溶液中①的离子方程式: 。
(3)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B为 。(写化学式)
(4)若A与B均为固体化合物,C是常见的一种中性干燥剂则反应①的方程式为
(5)A为红褐色难溶于水的固体,B为“84消毒液”的有效成分,两者在浓碱溶液中发生反应生成了高效环保的净水剂Na2FeO4,请写出此反应的离子方程式
(书写方程式请注意碱性介质的参与)
28.(13分) 某课外小组利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。
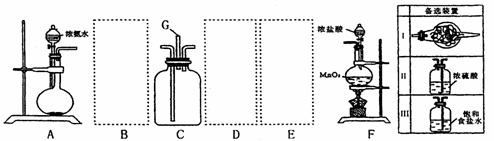
请回答下列问题:
(1)装置F中发生反应的离子方程式___________________________________________。
(2)装置A中烧瓶内的固体宜选用__________________________(选填以下选项的代号)
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.纯碱
(3)虚线内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列
空格。
B__________________、D_____________________。
(4)氯气和氨气在常温下相混合就会反应生成氯化铵和氮气,该反应的化学方程式为
_______________________________________________________。装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体就是氯化铵:
_______________________________________________________________________________
_______________________________________________________________________________
(5)若从装置C的G处逸出的尾气中含有N2和少量Cl2,应如何处理才能不污染环境?
_______________________________________________________________________________
29.(16分)(1)0.5mol某有机化合物CxHyOz完全燃烧生成4mol CO2和2 molH2O,其相对分子质量为136 ,该有机化合物CxHyOz的化学式为 ;
(2)据报道,目前我国结核病的发病率有抬头的趋势。拟制结核杆菌的药物除雷米封外,PAS-Na(对氨基水杨酸钠)也是其中的一种。它与雷米封可同时服,可以产生协同作用。已知:
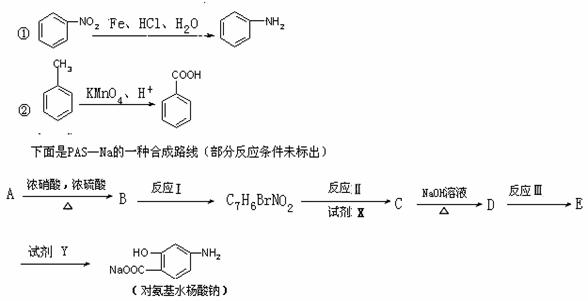
反应III加入的试剂是Fe、HCl、H2O
按照要求回答下列问题:
①写出下列反应的化学反应方程式并配平
A→B: ;
B→C7H6BrNO2: ;
②写出下列物质的结构简式:C: D
③指出反应类型:Ⅰ ,Ⅱ ;
④指出所加的试剂名称: X Y ;
⑸1mol对氨基水杨酸钠最多能与 molHCl反应。
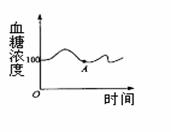
30.(20分)美国“发现号”航天飞机于2006年7月5日再次从肯尼迪航天中心成功发射升空。航天飞机飞行的过程中,地面指挥中心对宇航员的生理状况实施检测,下列图表就是检测的其中某一位宇航员的三项生理指标(体液pH值、体温、血糖)。
 请分析回答:
请分析回答:
|
体液 |
胃 液 |
唾液 |
血液 |
肠液 |
胰液 |
|
pH |
0.9-1.5 |
6.8 |
7.4 |
7.7 |
8.0 |
1)三项生理指标正常的是 。
2)人在饥饿时,当血液流经肝脏后,血糖浓度将会 ,原因是 。
3) 红细胞携带的氧进入脑细胞的线粒体中被利用,至少穿过 层生物膜。
4)某同学以清水、缓冲液(含Na2HPO4、KH2PO4的溶液,pH=7)和血浆分别为实
验材料进行实验,探究“血浆是否具有维持pH稳定的功能”,主要实验步骤
如下:
加入25ml实验材料 →测pH →滴加5 ml 0.1mol/L的HCl、摇匀
→测pH →倒去烧杯中溶液后充分冲洗 →重复实验并记录。
试回答下列有关问题:
⑴实验开始时都应测量三种材料的pH值,其目的是 。
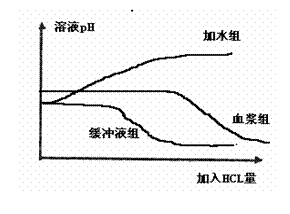 ⑵该同学用如图所示曲线来预期探究结果,试回答:
⑵该同学用如图所示曲线来预期探究结果,试回答:
① 预期结果中明显不符合科学的是 组,理由是 。
② 实验中清水组和缓冲液组起 作用。实验可以得出的结论是
。
 ⑶如果要证明血浆确实具有维持pH稳定的功能,本探究实验还应该补充
⑶如果要证明血浆确实具有维持pH稳定的功能,本探究实验还应该补充
。
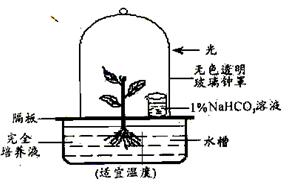
31、(22分)(一)根据右图所示装置(其中NaHCO3溶液可为植物提供CO2),利用学过的知识,简要回答下列问题:
⑴若将这个装置用来探究CO2是光合作用的原料,则还应该再增加一个装置,做法是
。
⑵若将这个装置用来探究元素X是否为植物的必需矿质元素,则还应该再增加一个装置,做法是 。为确保实验获得成功,则还应该适时地向水槽的培养液中通入空气,目的是 。
⑶若将这个装置培养苋菜,给苋菜植株提供14C标记的CO2,14C首先出现在 化合物中;若改变其中实验条件,短期内14C仍能转移到该化合物中,但转移到葡萄糖中的量减少甚至停止,则改变的实验条件最可能是 。
13.将a g CuO和Fe2O3的混合物分成两等份,向其中一份中加入 b mL c mol/L的稀硫酸正好完全反应;另一份在加热的条件下用H2还原,反应完全时用去H2 d L(折算成标准状况)。则d等于
A.22.4bc×10-3
B.44.8bc×10-3
C.22.4(3a-4bc×10-3)
D.22.4(3a-4bc)×10-3
12.在密闭容器中进行反应2SO2(g)+O2 (g) 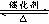 2SO3(g);△H<O;下图是某次实验的化学反应速率随时间变化的图形,推断在t1时刻突然变化的条件可能是
2SO3(g);△H<O;下图是某次实验的化学反应速率随时间变化的图形,推断在t1时刻突然变化的条件可能是
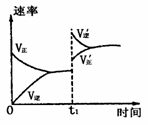 A.减小容器的体积,增大压强
A.减小容器的体积,增大压强
B.使用催化剂
C.升高体系的温度
D.增大生成物浓度,减小反应物浓度
11.己烯雌酚是一种激素类药物,结构如下,下列有关叙述中正确的是
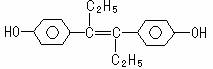
A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B.1mol该有机物可以与5mol Br2发生反应
C.可与NaOH和NaHCO3发生反应
D.该有机物分子中,所有碳原子都不可能共平面
10.下列有关实验中,用所选用试剂(括号内物质)不能达到实验目的的是
A.证明FeCl2溶液被氧化(KSCN溶液)
B.除去C2H2中的H2S气体(CuSO4溶液)
C.鉴别SO2和CO2两种气体(溴水)
D.检验Na2SO4溶液中是否混有NaCl(AgNO3)溶液
9.下列各组离子在指定溶液中能大量共存的是
①无色溶液中:K+、Na+、Cu2+、OH-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
④由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe3+的溶液中: Na+、NH4+、SCN-、HCO3-
⑥酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-
A.①② B.③⑥ C.②④ D.③⑤
8.下列反应的离子方程式正确的是
A.醋酸铵溶液和盐酸反应:CH3COONH4+H+=CH3COOH+NH4+
B.硫化钠水解:S2-+2H2O H2S+2OH-
H2S+2OH-
C.向次氯酸钙溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O=CaSO3
D.向稀氨水中加入稀盐酸:NH3·H2O+H+=NH4++H2O
7.用NA表示阿伏加德罗常数,下列说法正确的是
A.标准状态下,22.4L的NH3和CH4的混合气体所含的电子数为10NA
B.1mol P4中含有的共价键为4NA
C.0.2mol过氧化氢完全分解转移的电子数目为0.4NA
D.在标准状况下,2.24L一氧化氮与1.12L氧气混合后所分子数为0.3NA
6.作为新世纪的年轻公民都应具有一定的化学科学素养,否则,在工作和生活中就可能闹笑话。下列有关媒体的报道与化学知识不相违背的是
A.这种人工皂不含任何化学物质
B.该科研人员发明了一种特殊催化剂,可以使水变为汽油
C.“白雪牌”漂粉精可令所有有色物质黯然失“色”,没有最白,只有更白
D.该科研机构发明了一种用植物秸秆生产乙醇的新工艺
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com