
题目列表(包括答案和解析)
(二)填空题:
1.要使H2O和H2O2(过氧化氢)中,含有相同质量的氧元素,则H2O与H2O2的质量比是____,分子数均为6.02×1023个的H2、N2、CO的质量比为____.
2.露天烧烤不仅产生大量有害气体污染环境,而且烧焦肉类中还含有强烈的致癌物质3.4-苯并茈.其化学式为C20H12.该物质126g中含碳元素质量____g.
3.某碳酸钙样品中含碳元素的质量分数为6%(杂质不含碳元素), 则样品中CaCO3的质量分数为____.
则样品中CaCO3的质量分数为____.
4.右图是一种氮肥包装标签的部分文字.这种氮肥
的相对分子质量是____,其纯度(即化肥中硝酸铵
的质量分数)是____.
5.山茶油中含柠檬醛.现从山茶油中提取76g柠檬醛,将它在氧气中完全燃烧,生成220g二氧化碳和72g水,则柠檬醛中含有的元素是____.(填元素符号)
6.尼古丁的化学式为CxHyNz,其相对分子质量为162,其中氢约占8.7%,氮约占17.3%,则化学式中x=____,y=____,z=____.
(一)选择题:
1.有一种氮的氧化物,氮与氧的质量比为7:4,则该氧化物的化学式为( )
A.N2O B.NO2 C.N2O3 D.N2O5
2.硫酸亚铁可用于治疗缺铁性贫血.某贫血患者每天需补充1.40g铁元素,服用的药物中含硫酸亚铁的质量至少为( )
A.3.80g B.6.95g C.10.00g D.3.18g
3.下列化合物中,铁元素质量分数最小的是( )
A.FeO B.Fe2O3 C.Fe3O4 D.FeS
4.某气体单质和氧气的相对分子质量比为7:8,该气体可能是( )
A.CO B.CO2 C.Cl2 D.N2
5.氧化镁和另一种金属氧化物组成的混合物4g,含氧元素1.8g,另一种金属氧化物是( )
A.CuO B.Fe2O3 C.Al2O3 D.CaO
6.由Na2SO4、Na2SO3和Na2S三种物质组成的混合物中,含氧元素的质量分数为22%,则其中钠元素的质量分数为( )
A.23% B.46% C.32.6% D.无法确定
例1:原计划用90kg尿素[CO(NH2)2],现因缺货改用硝酸铵(NH4NO3).计算需要用多少千克的硝酸铵才能与90kg尿素的含氮量相等?
解法1:设需要硝酸铵质量为x,
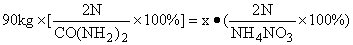
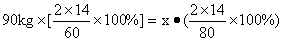
x=120kg
答:需用120kg的NH4NO3.
解法2:设需要硝酸铵质量为x.
据关系式NH4NO3 - CO(NH2)2
80 60
x 90kg
80:60=x:90kg
x=120kg
答:需用NH4NO3120kg.
例2:某铁的氧化物中,铁元素与氧元素的质量比为7:2,试确定该氧化物的化学式.
解法1:设该氧化物的化学式为FexOy,则
56x:16y=7:2 x:y=1:1
∴氧化物的化学式为FeO.
答:该氧化物化学式为FeO.
解法2:Fe、O两种元素的原子个数比为:
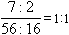
∴氧化物化学式为FeO
答:该氧化物化学式为FeO.
例3:在FeSO4和Fe2(SO4)3组成的混合物中,硫元素的质量分数为a%,求铁元素的质量分数是多少?
解:设混合物中氧元素的质量分数为x,
据关系式S - 40
32 64
a% x
32:64=a%:x x=2a%
∴铁元素质量分数为1-a%-2a%=1-3a%
答:铁元素质量分数为1-3a%.
例4:某硝酸铵样品中混有另一种氮肥,经测定该样品中含氮38%,则该样品中可能混有的氮肥是( )
A.NH4HCO3 B.(NH4)2SO4 C.NH4Cl H2)2
解析:先求出纯净的硝酸铵的含氮量为35%,已知样品中含氮量为38%,所以样品中一定混有含氮量比38%更高的氮肥.计算已知各种氮肥的含氮量分别为:
NH4HCO3 17.7% (NH4)2SO4 21.2% NH4Cl 26.2% CO(NH2)2 46.7%
所以答案为D.
5.两种元素的原子个数比等于它们的质量比除以相对原子质量之比.
4.两种物质的质量比等于相对分子质量×分子个数之比.
3.常用的计算关系式(以化合物AmBn为例):
(1)相对分子质量=A的相对原子质量×m+B的相对原子质量×n
(2)A的质量分数
(3)A、B元素的质量比
(4)A元素的质量=化合物质量×A的质量分数
(5)在混合物中,某物质的质量分数(纯度)
 (杂质不含该元素时)
(杂质不含该元素时)
2.化学式(分子式)表示的含义:
(1)表示该物质的一个分子.
(2)表示构成一个分子的各种原子的原子个数.
(3)表示一种物质及组成该物质的各种元素.
1.化学式:用元素符号来表示物质组成的式子.
(二)计算题:
1.把4g硫粉放在给定质量的氧气中燃烧,有关实验数据如下表所示.
|
|
第一次 |
第二次 |
第三次 |
|
O2质量(g)
|
3 |
4 |
6 |
|
SO2质量(g)
|
6 |
|
|
(1)第一次实验中,参加反应的S、O2、生成的SO2三种物质的质量比为:____;
(2)通过计算求出第二次实验生成SO2多少克?
(3)在表中填写第三次实验生成SO2的质量.
2.把10gKClO3和MnO2的混合物加热到不再产生气体为止,质量减少了2.4g.计算原混合物中KClO3的质量分数.
3.CO和CO2的混合气体10g,通过足量灼热的CuO,充分反应后,产生气体通入足量石灰水,得沉淀25g.求原混合物中CO的质量.
4.一定量的石灰石与50g稀盐酸恰好完全反应,生成CO2 2.2g,求:(1)参加反应的CaCO3的质量;(2)盐酸的溶质质量分数.
5.实验室用CO还原赤铁矿石(主要成分为Fe2O3)样品3.0g,反应后生成的CO2通入足量的石灰水中,生成4.0g白色沉淀,求赤铁矿石中Fe2O3的质量分数.
6.用H2还原Cu和CuO的混合物2g,完全反应后得到红色固体1.68g,求原混合物中金属铜的质量分数.
7.3.6g CaCO3高温煅烧一段时间后,冷却,测得剩余固体中含钙元素57.6%,求剩余固体中CaO的质量.
8.某样品为Cu和CuO的混合物,为测定样品中CuO的含量,取用20g此样品,分四次向其中加入稀盐酸与之充分反应.相应数据见下表:
|
第 次 |
加入稀盐酸的体积/mL |
剩余固体的质量/g |
|
1 |
40 |
16 |
|
2 |
40 |
12 |
|
3 |
40 |
8 |
|
4 |
40 |
8 |
求:(1)20g此样品中Cu的质量
(2)样品中CuO的质量分数
(3)用氢气充分还原5g此样品可得到固体多少克?
(一)选择题:
1.铝在氧气中燃烧生成氧化铝.在这个反应中,铝、氧气、氧化铝的质量比是( )
A.27:32:102 B.27:24:43 C.4:3:2 D.108:96:204
2.现有氢气和氧气共10g,点燃使之充分反应,生成7.2g水,则反应前氧气质量可能是( )
A.0.8g B.3.6g C.6.4g D.9.2g
3.在反应X+2Y=R+2M中,当1.6gX与Y完全反应后,生成4.4gR,且反应生成R和M的质量比为11:9,则在此反应中Y和M的质量之比为( )
A.23:9 B.16:9 C.32:9 D.46:9
4.在反应A+3B=2C+3D中,已知2.3gA跟4.8gB恰好完全反应,生成4.4gC,又知D的相对分子质量为18,则A的相对分子质量为( )
A.23 B.46 C.48 D.92
5.铜和氧化铜的混合物9g,与氢气充分反应后,得到固体物质8g,则原混合物中铜元素的质量分数为( )
A.88.9% B.80.0% C.11.1% D.61.5%
6.相同质量的Na2CO3、K2CO3、MgCO3、CaCO3四种物质,分别与足量的盐酸反应,产生CO2最多的是( )
A.Na2CO3 B.K2CO3 C.MgCO3 D.CaCO3
7.1.4g某二价金属与稀硫酸完全反应后得0.5gH2,则金属的相对原子质量为( )
A.24 B.27 C.56 D.65
8.两种金属混合物共13g,与足量稀硫酸反应后,产生1gH2,该混合物可能是( )
A.Zn和Al B.Fe和Mg C.Fe和Zn D.Al和Mg
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com