
题目列表(包括答案和解析)
14.下面的应用中利用了多普勒效应的是
A.利用地球上接收到的遥远天体发出的光波的频率来判断遥远天体相对于地球在连线方向的运动速度
B.交通警察向行进中的汽车发射一个已知频率的电磁波,波会被运动的汽车反射回来,再根据接收到的频率发生的变化来判断汽车的速度,以便于进行交通管理
C.铁路工作者用耳贴在铁轨上可判断火车的运行快慢
D.有经验的战士从炮弹飞行的尖叫声判断飞行炮弹是接近还是远去
15.铁道部决定的火车大提速,使旅客列车在行驶距离为l 000 km左右实现“夕发朝至”以满足旅客需求.为了适应提速的要求,以下措施可行的是
①机车的功率可保持不变 ②机车的功率必须增大
③铁路转弯处的路基坡度应增大 ④铁路转弯处的路基坡度应减小
A.①③ B.①④ C.②③ D.②④
16. 对一定量的气体,若用N表示单位时间内与器壁单位面积碰撞的分子数,则
A.当体积减小时,N必定增加
B.当温度升高时,N必定增加
C.当压强不变而体积和温度变化时,N必定变化
D.当压强不变而体积和温度变化时,N可能不变
17.篮球运动员通常要伸出两臂迎接传来的篮球.接球时,两臂随球迅速收缩至胸前.这样做可以
A.减小球对手的冲量 B.减小球对人的冲击力
C.减小球的动量变化量 D.减小球的动能变化量
18. 处于激发状态的原子,如果在入射光的电磁场的影响下,引起高能态向低能态跃迁,同时两个状态之间的能量差以辐射光子的形式发射出去,这种辐射叫做受激辐射,原子发生受激辐射时,发出的光子的频率、发射方向等,都跟入射光子完全一样,这样使光得到加强,这就是激光产生的机理,那么发生受激辐射时,产生激光的原子的总能量En、电子的电势能Ep、电子动能Ek的变化关系是
A.Ep增大、Ek减小、En减小 B. Ep减小、Ek增大、En减小
C.Ep增大、Ek增大、En增大 D.Ep减小、Ek增大、En不变
19.为了观察晶体的原子排列,可以采用下列方法:(1)用分辨率比光学显微镜更高的电子显微镜成像(由于电子的物质波波长很短,能防止发生明显衍射现象,因此电子显微镜的分辨率高);(2)利用x射线或中子束得到晶体的衍射图样,进而分析出晶体的原子排列.则下列分析中正确的是
A.电子显微镜所利用的电子的物质波的波长比原子尺寸小得多
B.电子显微镜中电子束运动的速度应很小
C.要获得晶体的x射线衍射图样,x射线波长要远小于原子的尺寸
D.中子的物质波的波长可以与原子尺寸相当
20. 环型对撞机是研究高能粒子的重要装置,其核心部件是一个高真空的圆环状的空腔,若带电粒子初速可视为零,经电压为U的电场加速后,沿圆环切线方向注入对撞机的环状空腔内,空腔内存在着与圆环平面垂直的匀强磁场,磁感应强度大小为B.带电粒子将被局限在圆环状空腔内运动.要维持带电粒子在圆环内做半径确定的圆周运动,下列说法中正确的是
A.对于给定的加速电压,带电粒子的比荷q/m越大,磁感应强度B越大
B.对于给定的加速电压,带电粒子的比荷q/m越大,磁感应强度B越小
C.对于给定的带电粒子,加速电压U越大,粒子运动的频率越小
D.对于给定的带电粒子,不管加速电压U多大,粒子运动的周期都不变
21. 如图所示,长为L的木板水平放置,在木块的A端放置一个质量为m的小物体,现缓慢抬高A端,使木板以左端为轴转动,当木板转到与水平成a角时小物体开始滑动,此时停止转动木板,小物体滑到木板底端时的速度为v,则在整个过程中

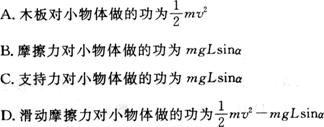
第Ⅱ卷(非选择题)
22.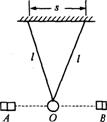 (1)(6分)如图所示,某同学采用双线摆和光电计数器测重力加速度.已 知每根悬线长l,两悬点间距s,金属小球半径为r,A、B为光电计数器.将小球垂直于纸面向外拉动,使悬线偏离竖直方向一个较小的角度并由静止释放,同时启动光电计数器.当小球第一次经过图中虚线(光束)位置O时,由A射向B的光束被挡住,计数器计数一次,显示为“1”,同时由零开始计时.而后每当小球经过O点时,计数器都要计数一次.当计数器上显示的计数刚好为n(n为奇数)时,计时时间为t.由此可知双线摆的振动周期T为
;计算重力加速度g时,双线摆的等效摆长L为 ;最后依据公式g= ,代入周期T和等效摆长L的值即可求出.
(1)(6分)如图所示,某同学采用双线摆和光电计数器测重力加速度.已 知每根悬线长l,两悬点间距s,金属小球半径为r,A、B为光电计数器.将小球垂直于纸面向外拉动,使悬线偏离竖直方向一个较小的角度并由静止释放,同时启动光电计数器.当小球第一次经过图中虚线(光束)位置O时,由A射向B的光束被挡住,计数器计数一次,显示为“1”,同时由零开始计时.而后每当小球经过O点时,计数器都要计数一次.当计数器上显示的计数刚好为n(n为奇数)时,计时时间为t.由此可知双线摆的振动周期T为
;计算重力加速度g时,双线摆的等效摆长L为 ;最后依据公式g= ,代入周期T和等效摆长L的值即可求出.
(2)(12分)如图甲所示为一黑箱装置,盒内有电源、电阻等元件,a、b为黑箱的两个输出端.
 1)为了探测黑箱,某同进行了以下几步测量:
1)为了探测黑箱,某同进行了以下几步测量:
①用多用电表的电阻挡测量a、b间的电阻;
②用多用电表的电压挡测a、b间的输出电压
③用多用电表的电流挡测量a、b间的输出电流. 你认为以上测量中不妥的有: (填序号),理由是:
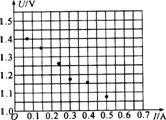 2)含有电源的黑箱相当于一个“等效电源”,a、b是等效电源的两极.为了测定这个等效电源的电动势和内阻,该同学设计了如图乙所示的电路,调节变阻器的阻值,记录下电压表和电流表的示数,并在如图所示的方格纸上建立了U-I坐标,根据实验数据画出了坐标点,如图所示.请你作进一步处理,并由图求出等效电源的电动势E= V,内阻r= Ω.
2)含有电源的黑箱相当于一个“等效电源”,a、b是等效电源的两极.为了测定这个等效电源的电动势和内阻,该同学设计了如图乙所示的电路,调节变阻器的阻值,记录下电压表和电流表的示数,并在如图所示的方格纸上建立了U-I坐标,根据实验数据画出了坐标点,如图所示.请你作进一步处理,并由图求出等效电源的电动势E= V,内阻r= Ω.
3)由于电压表和电流表的内阻会产生系统误差,则采用此测量电路所测得的电动势与实际值相比 ,测得的内阻与实际值相比 (填“偏大”、“偏小”和“相同”).
23.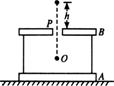 (16分)如图所示,相距为d的两完全相同的平行金属板A、B,质量均为M,带有等量异号电荷,其中A板放在绝缘的水平桌面上,B板正中央开有小孔P,A、B两板边缘处各有一粗细不计的绝缘细杆支撑,假定细杆对两板间的电场不产生任何影响.一质量为m、带电荷量为q的小球自距B板高h处由静止释放,通过小孔P后到达两板正中央位置0时,速度变为零.不计空气阻力和细杆质量,重力加速度为g,求:
(16分)如图所示,相距为d的两完全相同的平行金属板A、B,质量均为M,带有等量异号电荷,其中A板放在绝缘的水平桌面上,B板正中央开有小孔P,A、B两板边缘处各有一粗细不计的绝缘细杆支撑,假定细杆对两板间的电场不产生任何影响.一质量为m、带电荷量为q的小球自距B板高h处由静止释放,通过小孔P后到达两板正中央位置0时,速度变为零.不计空气阻力和细杆质量,重力加速度为g,求:
(1)A、B两板间的电势差;
(2)当小球在A、B两板间速度为零时,A板对水平桌面压力的大小.
24. (18分)如图所示,质量为3m,长为L的木块,置于光滑水平面上,质量为m的子弹以速度v0水平向右射穿木块,穿出时速度为v0/2.设木块对子弹的阻力恒定,根据上述条件,能求出上述过程中木块的一些运动物理量,例如射穿过程中木块的位移大小.请将所能求的运动物理量用m、v0、L表示出来.
(18分)如图所示,质量为3m,长为L的木块,置于光滑水平面上,质量为m的子弹以速度v0水平向右射穿木块,穿出时速度为v0/2.设木块对子弹的阻力恒定,根据上述条件,能求出上述过程中木块的一些运动物理量,例如射穿过程中木块的位移大小.请将所能求的运动物理量用m、v0、L表示出来.
25.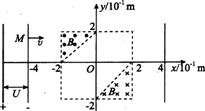 (20分)如图所示,在直角坐标系的第Ⅱ象限和第Ⅳ象限中的直角三角形区域内,分布着磁感应强度均为B=5.O×lO-2T的匀强磁场,方向分别垂直纸面向外和向里。质量为m=6.4×10-27kg、电荷量为q=+3.2×10-19C的a粒子(不计a粒子重力),由静止开始经加速电压为U=1250 V的电场加速后,从坐标点M(-4,
(20分)如图所示,在直角坐标系的第Ⅱ象限和第Ⅳ象限中的直角三角形区域内,分布着磁感应强度均为B=5.O×lO-2T的匀强磁场,方向分别垂直纸面向外和向里。质量为m=6.4×10-27kg、电荷量为q=+3.2×10-19C的a粒子(不计a粒子重力),由静止开始经加速电压为U=1250 V的电场加速后,从坐标点M(-4,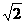 )处平行于x轴向右运动,并先后通过匀强磁场区域。
)处平行于x轴向右运动,并先后通过匀强磁场区域。
(1)求出a粒子在磁场中的运动半径;
(2)在图中画出a粒子从直线x=-4到直线x=4之间的运动
轨迹,并在图中标明轨迹与直线x=4交点的坐标;
(3) 求出a粒子在正方形区域运动通过的路程
(4) 求出a粒子在两个磁场区域偏转所用的总时间。
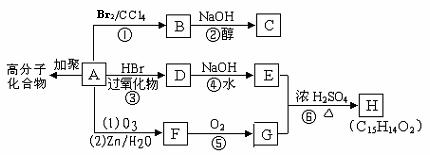
26.(12分)A、B、C、D是原子序数依次增大的四种短周期非金属元素,B、C、D同周期,A、C同主族。B单质在A单质中点燃产生白烟,而B单质在D单质中点燃产生白色烟雾。C单质在空气中点燃可生成化合物M,B的最高价氧化物为N。
(1)写出:D的元素符号 ,B的气态氢化物的电子式 。
(2)B单质在D单质中点燃的化学方程式 。
(3)在一定条件下,B单质可以跟C的最高价氧化物反应生成M和N,写出该反应的化学方程式 。
27.(16分)已知A、B、C、D、E、F、G、H、I是由短周期元素组成的单质和化合物,其中A、B、E、F、I均含同一种元素。B、C、H为气体单质,C是人类生命活动中不可缺少的物质,D为无色液体。物质A是一种常见的化肥,又可以用做炸药。G的浓溶液常呈现黄色,G与I混合时产生白烟。下面是A-I这几种物质在一定条件下的转化关系(有些产物与反应条件已略去)
回答下列问题:
(1)物质A的化学式 。
(2)物质G浓溶液显黄色的原因(用化学方程式表示) ,在实验室里应如何保存该浓溶液? 。
(3)写出D与F反应生成G的化学方程式 ,其中氧化剂和还原剂的物质的量比为 。
(4)高铁酸钠(Na2FeO4)是一种新型的净水剂,FeO42-在酸性溶液中,迅速生成Fe3+和C气体,写出该反应的离子方程式: 。
(5)工业上生产I时,要提高反应物的转化率,实际生产中采取的措施是
。
28.(16分)某校化学课外活动小组设计了如下图所示的实验装置,利用某工业废气(主要成分为CO、CO2、水蒸气),通过称量装置D的质量,来测定某种铁的氧化物样品的组成。看图回答下列问题:
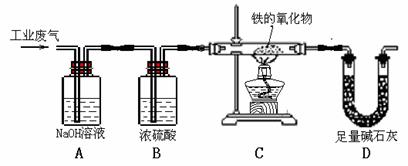
(1)甲同学认为从保护环境的角度看,此装置有不足之处,请你写出改进的方案:
。
(2)乙同学认为若用甲改进过的装置进行实验,测定出的装置D的质量有可能偏大,因此该装置尚需进一步改进。若在实验过程中不考虑空气中的H2O和CO2的影响,请你写出装置D质量可能偏大的原因 ,应该如何改进? 。
(3)若C中铁的氧化物化学式为FeXOY,写出C中反应的化学方程式: 。
在点燃C处酒精灯以前应进行的操作是 。
(4)若装置设置合理,且反应进行的完全,已知:样品的质量为15.2g, D装置增加的质量为11.0g,试确定该氧化物化学式中 X∶Y = 。若该样品是由2种铁的氧化物混合而成,其组分(要求只写出一组组分的化学式)的物质的量的比为: 。
29.(16分)已知:
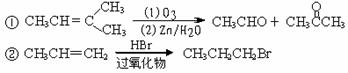
1mol某芳香烃A,充分燃烧可以得到8molCO2和4molH2O。烃A可通过如下图的各个反应得到各种化合物和聚合物。
回答下列问题:
(1)在①-⑥的反应中属于取代反应的是(填编号) 。
(2)写出下列物质的结构简式:D ,H 。
(3)在A-H这8种物质中,分子中的所有原子肯定在同一平面上的是(填字母代号):
。
(4)写出下列反应的化学方程式:
①B--C ,
②F--G 。
(5)M是G的同系物,比G多一个碳原子。写出两种符合下列要求的M的同分异构体的结构简式:①两个取代基处于对位;②能发生银镜反应。
。
30、(22分)下图为植物和高等动物(如人体)新陈代谢的部分过程示意图,请分析回答:
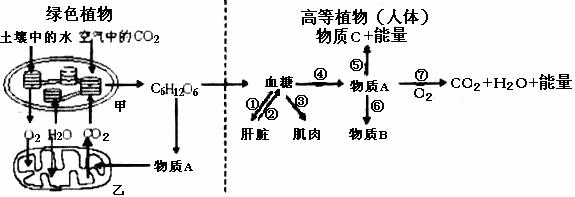
(1)影响甲中生理活动正常进行的非生物因素有 (至少写出三个)。
(2)图中甲、乙两种结构的膜面积都很大,其中甲的膜面积大是由于 ,乙的膜面积大是由于 。
(3)绿色植物在光照充足,且光照强度不变的条件下,如适当提高空气中的CO2含量,短时间内C3含量将 (增加或减少)。
(4)当植物的叶肉细胞的CO2释放量为0时,细胞内产生的CO2的主要扩散方向是从
到 (填结构名称),它将通过 层磷脂双分子层。
(5)人如果处于饥饿状态, (激素)分泌增加,促使 (填序号)过程的进行。
(6)发生在高等动物细胞结构乙中的生理过程是 (填序号),在缺氧情况下,物质A可通过⑤过程形成物质C (填名称)。
31、(20分)(一)某二倍体植物的体细胞中染色体数为24条,基因型为AaBb。请据图完成问题。
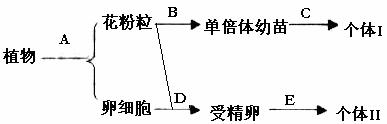
①产生的花粉粒基因有 种。由花粉粒发育成的单倍体植株有哪几种基因型
。
②若C处是指用秋水仙素处理。则个体I的体细胞中含染色体 条。
③若要尽快获得纯种的矮杆抗病(aaBB)的水稻,则应采用上图中的 (用字母表示)过程进行育种,这种育种方法称为 。
13.反应:L(s)+aG(g) bR(g)达到
bR(g)达到 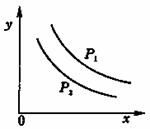
平衡时,温度和压强对该反应的影响如图所示:
图中:压强p1>p2, x轴表示温度,y轴表示
平衡混合气中G的体积分数。据此可判断
A 上述反应是放热反应
B 上述反应是吸热反应
C a>b D a+1<b
12.已知酸性大小:羧酸>碳酸>酚。下列含溴化合物中的溴原子,在适当条件下都能被羟基 (-OH)取代(均可称为水解反应),所得产物能跟NaHCO3溶液反应的是

11.在100m L0.2mol/L NH3·H2O溶液中,欲使NH3·H2O溶液的p H变小,可采用的方法是:
①加热至沸腾;②加少量NaOH固体;③加100m L水;④加20m L0.4mol/L NH3·H2O溶液
A.①③ B.①③④ C.②③ D.只有④
10.甲、乙、丙、丁分别是 Al2(SO4)3 ,FeSO4,NaOH,BaCl2四种物质中的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生,据此可推断丙物质是
A.Al2(SO4)3 B.NaOH C.BaCl2 D.FeSO4
9.下列实验操作或对实验事实的叙述不正确的是
A.用碱式滴定管量取20.00mL0.1000mol/L KMnO4 溶液
B.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌
C.配制Al2(SO4)3溶液时,加入少量的稀硫酸
D.用稀HNO3清洗做过银镜反应实验的试管
8.下列各组离子在水溶液中能大量共存的是
A.I-‑、ClO-、NO3-、H+ B.K+、NH4+、HCO3-‑、OH-
C.H+、Na+、AlO2-、HSO3- D.SO32-、SO42-、Cl-、OH-
7.一定质量的无水乙醇完全燃烧生成液态水时放出的热量为QkJ,它所生成的CO2用过量饱和石灰水完全吸收,可得100gCaCO3沉淀,下列表示乙醇燃烧热的热化学方程式正确的是
A.C2H5OH(l)+ 3O2(g)= 2CO2(g)+ 3H2O(l);△H= -QkJ/mol
B.C2H5OH(l)+ 3O2(g)= 2CO2(g)+ 3H2O(l);△H= -2QkJ/mol
C. C2H5OH(l)+
C2H5OH(l)+ 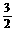 O2(g)= CO2(g)+
O2(g)= CO2(g)+  H2O(l);△H= -QkJ/mol
H2O(l);△H= -QkJ/mol
D.C2H5OH(l)+ 3O2(g)= 2CO2(g)+ 3H2O(l);△H= +2QkJ/mol
6.氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的是
A.35Cl原子所含质子数为18 B.3.5 g的35Cl2气体的体积为2.24 L
C.1/18 mol的1H35Cl分子所含中子数约为6.02×1023 D.35Cl2气体的摩尔质量为71 g/mol
5.在预防传染病的疫苗家族中近年又增加了一种核酸疫苗(又称DNA疫苗),它们是由病原微生物中的一段可表达为抗原的基因制成。以下关于核酸疫苗的叙述不正确的是
A.核酸(DNA)疫苗需要导入人体细胞而发挥作用
B.导入人体的核酸疫苗可直接导致体内产生抗体,因此起到免疫作用
C.核酸疫苗的接种可以达到预防特定的微生物感染的目的
D.核酸疫苗接种后引起人体产生的抗体是由效应B细胞合成的
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com