
题目列表(包括答案和解析)
1.

 (09四川绵阳)
(09四川绵阳)
|

 ①在空气中点燃镁带:2Mg+O2=====2MgO
①在空气中点燃镁带:2Mg+O2=====2MgO

 ②用稀盐酸除铁锈:FeO+2HCl=== FeCl2+H2O。
②用稀盐酸除铁锈:FeO+2HCl=== FeCl2+H2O。

 ③用锌粒和稀盐酸制氢气:Zn +2HC1=====ZnCl2+H2↑
③用锌粒和稀盐酸制氢气:Zn +2HC1=====ZnCl2+H2↑

 ④将主要成分为碳酸钙的贝壳投入稀盐酸:CaCO+HCl===CaCl2+CO2↑+ H2O
④将主要成分为碳酸钙的贝壳投入稀盐酸:CaCO+HCl===CaCl2+CO2↑+ H2O

 A.①②
B.③④ C.①③ D.②④
A.①②
B.③④ C.①③ D.②④

 关键词:化学方程式的应用
关键词:化学方程式的应用

 答案:D
答案:D
4.

 在工业中硫酸铜有不少用途。某工厂用硫化铜(CuS)制硫酸铜(CuSO4),拟选择两个方案。
在工业中硫酸铜有不少用途。某工厂用硫化铜(CuS)制硫酸铜(CuSO4),拟选择两个方案。
|
方案 |
方案① |
方案② |
|
原理 |
CuS是在硫杆菌(催化剂)的作用下与空气中的氧气发生化合反应生成硫酸铜。 |
2CuS+3O2 2CuO+2SO2 2CuO+2SO2   CuO+H2SO4==CuSO4+H2O CuO+H2SO4==CuSO4+H2O |
(1)请写出方案①反应的化学方程式___ 。



 (2)在两个方案中①更合理。理由是方案①具有以下优点:优点一:__________,优点二:__________。
(2)在两个方案中①更合理。理由是方案①具有以下优点:优点一:__________,优点二:__________。









 答案 课题2 1.D 解析:先根据反应前后物质的质量改变,确定反应物和生成物。反应后质量减少的是反应物,反应后质量增加的是生成物。故X是反应物,Y、Z是生成物。由于生成物Y和Z的质量和为2+14=16.大于参加反应的X的质量4,故Q也是反应物,且有12gQ参加反应。Y和Q发生改变的质量比为2:12 。再设X的计量数为a,Q的计量数为b,则X和Q的质量比为:a·n:b·2n=4:12,解得;a:b=2:3. 2.D 解析:该题采用代入法。利用相对分子质量的比等于实际质量的比时,化学方程式才正确。3.C 4.(1)CuS+2O2
答案 课题2 1.D 解析:先根据反应前后物质的质量改变,确定反应物和生成物。反应后质量减少的是反应物,反应后质量增加的是生成物。故X是反应物,Y、Z是生成物。由于生成物Y和Z的质量和为2+14=16.大于参加反应的X的质量4,故Q也是反应物,且有12gQ参加反应。Y和Q发生改变的质量比为2:12 。再设X的计量数为a,Q的计量数为b,则X和Q的质量比为:a·n:b·2n=4:12,解得;a:b=2:3. 2.D 解析:该题采用代入法。利用相对分子质量的比等于实际质量的比时,化学方程式才正确。3.C 4.(1)CuS+2O2 CuSO4 (2)不产生有毒气体 不需要加热
CuSO4 (2)不产生有毒气体 不需要加热









3.


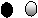 (2007·浙江)下图是用来表示物质间发生化学变化的模型示意图,图中“ 、 ”分别表示两种不同元素的原子。能用该示意图表示的反应是
( )
(2007·浙江)下图是用来表示物质间发生化学变化的模型示意图,图中“ 、 ”分别表示两种不同元素的原子。能用该示意图表示的反应是
( )


 A.2H2+O2
A.2H2+O2 2H2O B.2H2O
2H2O B.2H2O  2H2↑+O2↑
2H2↑+O2↑



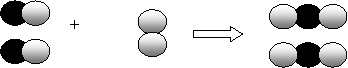 C.2CO+O2
C.2CO+O2 2CO2 D.H2+Cl2
2CO2 D.H2+Cl2 2HCl
2HCl









2.

 将25g甲物质、5g乙物质、10g丙物质混合加热,发生反应。经分析,反应后混合物中含10g甲和21g丙,还有一种新物质丁。若已知甲、乙、丙、丁的相对分子质量分别30、20、44、18,并用a、b、c、d分别表示它们的化学式,则它们之间发生反应的化学方程式是( )
将25g甲物质、5g乙物质、10g丙物质混合加热,发生反应。经分析,反应后混合物中含10g甲和21g丙,还有一种新物质丁。若已知甲、乙、丙、丁的相对分子质量分别30、20、44、18,并用a、b、c、d分别表示它们的化学式,则它们之间发生反应的化学方程式是( )


 A.a+b=c+d B.a+2b=2c+d C.2a+b=2c+d D.2a+b=C+2d
A.a+b=c+d B.a+2b=2c+d C.2a+b=2c+d D.2a+b=C+2d
1.

 在一个密闭容器内有四种物质,在一定条件下充分反应后,测得反应前后各物质的质量如下:
在一个密闭容器内有四种物质,在一定条件下充分反应后,测得反应前后各物质的质量如下:
|
物质 |
X |
Y |
Z |
Q |
|
反应前质量/g |
4 |
10 |
1 |
21 |
|
反应后质量/g |
0 |
12 |
15 |
待测 |
已知X的相对分子质量为n,Q的相对分子质量为2n。下列推理正确的是( )


 A.参加反应的Q的质量为9g
B.反应后生成15gZ
A.参加反应的Q的质量为9g
B.反应后生成15gZ


 C.反应中Y与Q发生改变的质量之比为1:1 D.该反应中x与Q的化学计量数之比为2:3
C.反应中Y与Q发生改变的质量之比为1:1 D.该反应中x与Q的化学计量数之比为2:3
19.

 经过学习我们可以初步认识到:化学反应的快慢、现象、生成物等与反应物量的多少、反应条件有着密切的关系。请各举一例说明:
经过学习我们可以初步认识到:化学反应的快慢、现象、生成物等与反应物量的多少、反应条件有着密切的关系。请各举一例说明:


 (1)使用催化剂,能改变化学反应的速率:
。
(1)使用催化剂,能改变化学反应的速率:
。


 (2)反应物的量不同,生成物可能不同:
。
(2)反应物的量不同,生成物可能不同:
。


 (3)反应物的量不同,反应现象可能不同:
。
(3)反应物的量不同,反应现象可能不同:
。




18.

 把铁粉和硫粉以适当的质量比均匀混合,堆放在石棉网,然后用烧红的玻璃棒的一端接触混合物。这时部分混合物迅速变成红热状态,移开玻璃棒后,反应继续剧烈进行,全部混合物呈红热状态,冷却后得到黑色的固体化合物--硫化亚铁。
把铁粉和硫粉以适当的质量比均匀混合,堆放在石棉网,然后用烧红的玻璃棒的一端接触混合物。这时部分混合物迅速变成红热状态,移开玻璃棒后,反应继续剧烈进行,全部混合物呈红热状态,冷却后得到黑色的固体化合物--硫化亚铁。


 ①这一变化的化学方程式是
。
①这一变化的化学方程式是
。


 ②铁跟硫反应时是吸收热量还是放出热量?
。
②铁跟硫反应时是吸收热量还是放出热量?
。


 ③用什么实验可以证实反应中铁已从游离态变成化合态
。
③用什么实验可以证实反应中铁已从游离态变成化合态
。


 ④从理论上计算,为使铁粉和硫粉都能全部反应,两者最佳质量比应是
。
④从理论上计算,为使铁粉和硫粉都能全部反应,两者最佳质量比应是
。
17.

 在化学反应中,物质所含元素的化合价发生变化的反应就是氧化-还原反应。
在化学反应中,物质所含元素的化合价发生变化的反应就是氧化-还原反应。


 例如:2Na +Cl2=2NaCl 反应前后,Na、Cl元素的化合价发生了变化,该反应是氧化-还原反应。(1)根据化合价是否变化分析,下列反应属于氧化-还原反应的是(填序号): 。
例如:2Na +Cl2=2NaCl 反应前后,Na、Cl元素的化合价发生了变化,该反应是氧化-还原反应。(1)根据化合价是否变化分析,下列反应属于氧化-还原反应的是(填序号): 。


 A.2Mg + O2 点燃 2MgO B.CaO + H2O= Ca(OH)2 C.2KClO3
A.2Mg + O2 点燃 2MgO B.CaO + H2O= Ca(OH)2 C.2KClO3 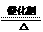 2KCl+3O2
↑
2KCl+3O2
↑


 D.CaCO3 高温 CaO + CO2↑
E.H2 + CuO 加热 Cu + H2O F.HCl + NaOH = NaCl +H2O
D.CaCO3 高温 CaO + CO2↑
E.H2 + CuO 加热 Cu + H2O F.HCl + NaOH = NaCl +H2O


 (2)根据上面的分析和推理,对四种基本反应类型是否属于氧化还原反应,做出恰当概括:
(2)根据上面的分析和推理,对四种基本反应类型是否属于氧化还原反应,做出恰当概括:


 置换反应
;化合反应
;
置换反应
;化合反应
;


 分解反应
;复分解反应 ;
分解反应
;复分解反应 ;
16.

 通过学习,我们已经知道了下列反应: ①C+O2
通过学习,我们已经知道了下列反应: ①C+O2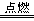 CO2
②2CO+O2
CO2
②2CO+O2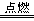 2CO2 ③CH4+2O2
2CO2 ③CH4+2O2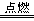 CO2+2H2O ④C2H5OH+3O2
CO2+2H2O ④C2H5OH+3O2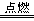 2CO2+3H2O
2CO2+3H2O


 通过对上述四个反应的化学方程式的分析,你能总结出哪些规律性的结论?
通过对上述四个反应的化学方程式的分析,你能总结出哪些规律性的结论?



15.

 写出下列有关化学方程式:
写出下列有关化学方程式:


 (1)法医常用马氏试砷法来证明是否为砒霜(As2O3)中毒,其原理是:用锌和盐酸与试样混合在一起,若试样中含有砒霜,则会发生反应,生成砷化氢(AsH3)、氯化锌和水,写出该反应的化学方程式: 。
(1)法医常用马氏试砷法来证明是否为砒霜(As2O3)中毒,其原理是:用锌和盐酸与试样混合在一起,若试样中含有砒霜,则会发生反应,生成砷化氢(AsH3)、氯化锌和水,写出该反应的化学方程式: 。


 (2)市售打火机里装的不是汽油,而是液体丁烷(C4H10),丁烷在空气中燃烧后产生二氧化碳和水蒸气,写出丁烷完全燃烧的化学方程式
。(3)二氧化钛(TiO2)是优良的白色颜色。它的生产工艺流程中,有一步反应是用四氯化钛(无色液体)跟空气中的水接触,即产生二氧化钛,并伴有大量酸雾。写出该反应的化学方程式:
。
(2)市售打火机里装的不是汽油,而是液体丁烷(C4H10),丁烷在空气中燃烧后产生二氧化碳和水蒸气,写出丁烷完全燃烧的化学方程式
。(3)二氧化钛(TiO2)是优良的白色颜色。它的生产工艺流程中,有一步反应是用四氯化钛(无色液体)跟空气中的水接触,即产生二氧化钛,并伴有大量酸雾。写出该反应的化学方程式:
。


 (4)烧水的铝壶中常结有一层水垢(水垢的主要成分是CaCO3),用适量的稀盐酸可以除去它,反应的化学方程式是
。若盐酸的用量过多,会损坏铝壶,原因是(写化学方程式)
。
(4)烧水的铝壶中常结有一层水垢(水垢的主要成分是CaCO3),用适量的稀盐酸可以除去它,反应的化学方程式是
。若盐酸的用量过多,会损坏铝壶,原因是(写化学方程式)
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com