
题目列表(包括答案和解析)
2.从1升10%的硫酸溶液中取出100毫升这种溶液,则100毫升硫酸溶液中溶质的质量分数为( )
A.1% B.10% C.11.1% D.9%
解析:溶液具有均一性,溶液的均一性是溶液的基本属性,与溶液的体积无关。
答案:B
1.对5%的食盐溶液含义的解释错误的是( )
A.100克水中溶解了5克食盐 B.100克食盐溶液中含有5克食盐
C.将5克食盐溶于95克水中所得溶液 D.该溶液中溶质与溶液的质量比为1∶20
解析:5%的食盐溶液是指100克溶液中含有5克溶质食盐。A项中溶液的质量分数为4.76%而不是5%。
答案:A
13.在“非典”期间,某市售过氧乙酸(化学式为CH3COOOH),其标签上的部分文字说明如下。请完成下列问题:
|
过氧乙酸 (质量:500 g/瓶) 成分名称 化学式 质量分数 过氧乙酸 C2H4O3 40% 水 H2O 55% 双氧水 H2O2 5% 性 质:强氧化性、酸性 主要用途:强氧化性、酸性 储存方法:密封、避光、避热,不可与可燃物混合存放,防猛烈撞击。 |
(1)从标签上的文字说明可以推知:过氧乙酸之所以避热储存,是因为过氧乙酸受热时像双氧水一样,容易发生分解,生成乙酸和一种单质气体。过氧乙酸加热分解的化学方程式是
__________________________________________________。
(2)一瓶这种溶液中含过氧乙酸溶质________________g。
(3)0.5%的过氧乙酸溶液可以杀死细菌和SARS病毒。某医院需配制0.5%的过氧乙酸,一瓶这种过氧乙酸需加多少克水?
思路解析:本题是一道紧密联系实际的商品标签试题。标签上提供了瓶装过氧乙酸的成分、性质、主要用途和储存方法。由于试题已明确告知过氧乙酸分解时生成乙酸和一种单质气体,且分解时像双氧水一样。显然题目在暗示这种单质气体是氧气。其实,即使题目中除掉“像双氧水一样”字眼,同样可以根据质量守恒定律来推测这种单质气体。由于含过氧乙酸的溶液质量分数为40%,则一瓶这种溶液中含过氧乙酸溶质质量:500 g×40%=200 g。第(3)问可以这样变换:某医院用500 g 40%的过氧乙酸溶液来配制0.5%的过氧乙酸,需加水多少克?经过这样的变换,就成了一道有关溶液稀释的计算题。在稀释前后,溶质过氧乙酸质量不会改变。
设应加水的质量为x,
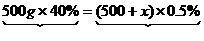
稀释前溶质质量 稀释后溶质质量
解得:x=39 500 g
答案:
(1)2CH3COOOH 2CH3COOH+O2↑
2CH3COOH+O2↑
(2)200
(3)39 500 g
12.长久使用的热水壶底部有一层水垢,主要成分是CaCO3和Mg(OH)2。某学校化学研究性学习小组的同学通过实验测定水垢中的CaCO3含量,取200 g水垢,加入过量的稀盐酸,同时测量5分钟内生成CO2的质量,结果如下表:
|
时间/分钟 |
1 |
2 |
3 |
4 |
5 |
|
质量/g |
30 |
50 |
60 |
66 |
66 |
试完成下列问题:
(1)4分钟后,水垢中CaCO3是否反应完全?
(2)该水垢中的CaCO3质量分数是多少?
思路解析:此题是一道数据分析题,解题的关键是从表中数据分析出在第4次实验后水垢已反应完全。
答案:(1)已反应完全
(2)由表可知,完全反应后,生成的CO2为66 g。设水垢中CaCO下标3 的质量为x
2HCl+CaCO3====CaCl2+H2O +CO2↑
100 100 44
X x 66 g
x=150 g
水垢中CaCO3的质量分数为150 g/200 g×100%=75%
11.侯德榜是我国著名的化学家。由他发明的侯氏制碱法制得的纯碱中可能含有少量氯化钠。现取仅含氯化钠杂质的纯碱样品33.2 g,加入到130 g稀盐酸中,恰好完全反应,得氯化钠溶液150 g。
求:(1)该纯碱样品中Na2CO3的质量。
(2)反应后所得溶液中溶质的质量分数。
思路解析:本题综合性较强,运用质量守恒定律(质量守恒法)求得生成CO2的质量是解题的关键。
设样品中含Na2CO3质量为x,生成NaCl的质量为y,依题意知产生CO2的质量为33.2 g+130 g-150 g=13.2 g。则:
Na2CO3+2HCl====2NaCl+CO2↑+H2O
106 117 44
x y 13.2 g
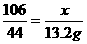 x=
x=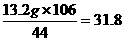 g
g
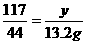 y=
y=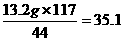 g
g
原样品中含NaCl:33.2 g-31.8 g=1.4 g
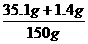 ×100%=24.3%
×100%=24.3%
答案:(1)该纯碱样品中Na2CO3为31.8 g
(2)所得溶液中溶质的质量分数为24.3%
10.浓度为98%,密度为1.84 g·cm-3的浓硫酸和水按1∶5的体积比配制硫酸溶液,求所得硫酸溶液的溶质的质量分数。
思路解析:设水为5 mL,浓H2SO4为1 mL。
溶质质量=1×1.84×98%≈1.8 g
溶液质量=1×1.84+5×1=6.84 g
A%=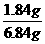 ×100%=26.9%
×100%=26.9%
答案:26.9%
9.(2006江苏徐州中考,22)溶液在生产和科研中具有广泛的用途。在农业上,为了选种子,需要配制15%的盐溶液。现有30 kg食盐固体,可配制食盐溶液_____________kg。配制食盐溶液的一般步骤为①__________________________;②__________________________;③溶解。
思路解析:根据质量分数公式计算出溶液的质量=30 kg÷15%=200 kg。配制溶液的步骤一般为:①计算;②称量固体和量取液体;③溶解。
答案:200 计算 称量固体和量取液体
8.15 ℃时,食盐的溶解度是35 g,求此时食盐溶液的溶质的质量分数。
思路解析:A%=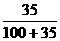 ×100%≈25.9%
×100%≈25.9%
答案:25.9%
我综合 我发展
7.5 g食盐溶解在95 g水中,计算所得溶液的溶质的质量分数。
思路解析:A%=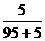 ×100%=5%
×100%=5%
答案:5%
6.用A、B两个烧杯各取90克溶质的质量分数为10%的硝酸钾溶液,再向A烧杯中加入10 g硝酸钾,向B烧杯中加入10 g水,并用玻璃棒搅拌至全部溶解。
[讨论]
(1)原溶液中溶质的质量是多少?溶液的质量是多少?溶剂的质量是多少?
(2)向原溶液中增加10克硝酸钾(全部溶解)或增加10克水后,溶液中溶质质量、溶剂质量、溶液质量各是多少?
思路解析:(1)溶液的质量=90克
溶质的质量=溶液质量×溶质的质量分数
=90克×10%=9克
溶剂的质量=溶液质量-溶质质量
=90克-9克=81克
(2)①增加10克硝酸钾后:
溶质质量=9克+10克=19克
溶剂质量=81克(不变)
溶液质量=19克+81克=100克(增加10克)
或90克+10克=100克
则可知:(1)增加10克溶质后:
溶质的质量分数= ×100%
×100%
=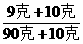 ×100%=19%
×100%=19%
注:若新增的10克溶质未完全溶解,则上述计算错误。
②加入10克水后:
溶质质量=9克(不变)
溶剂质量=81克+10克=91克(增加)
溶液质量=9克+91克=100克(增加10克)
或90克+10克=100克
则可知:增加10克水后:
溶质的质量分数= ×100%
×100%
=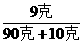 ×100%=9%
×100%=9%
答案:(1)9 g 90 g 81 g
(2)①加10 g KNO3时,19 g,81 g,100 g
②加10 g H2O时,9 g,91 g,100 g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com