
题目列表(包括答案和解析)
31、生活中的物质不属于有机物的是……………………………………………………( )
A、甲烷 B、酒精 C、淀粉 D、碳酸
30、下列属于同素异形体的是……………………………………………………………( )
A、 水和双氧水 B、冰和干冰
C、 二氧化碳和一 氧化碳 D、金刚石和石墨
氧化碳 D、金刚石和石墨
29、常见的物质中属于氧化物的是………………………………………………………( )
A、C2H5OH B、O2 C、H2O D、NaCl
28、钒(V)被誉为金属中的“维生素”,其氧化物V2O5 中钒元素的化合价是……………( )
A、+1 B、+3 C、+5 D、+7
27、 以下元素符号中正确的是 ………………………………………………………( )
以下元素符号中正确的是 ………………………………………………………( )
A、钠元素:NA B、铝元素:Al
C、汞元素:HG D、硅元素:SI
10.元素Z的核电荷数为a,它的阳离子Zm+与元素Y的阴离子Yn-的电子层结构相同,则元素Y的核电荷数是_________。
思路解析:离子是由原子失去或得到电子而形成的,且离子所带的电荷数等于原子形成离子时失去或得到的电子的数目,又Zm+?的核外电子数为a-m,若设Y的核电荷数为b,则Yn-核外电子数为b+n,又Zm+与Yn-电子层结构相同,则a-m=b+n,因此b=a-m-n。
答案:a-m-n
9.某粒子结构示意图为 则:
则:
(1)若该粒子为原子,则x与y的关系是____________。
(2)若该粒子为带两个单位正电荷的阳离子,则____________x=,y=____________。
(3)若该粒子为带两个单位负电荷的阴离子,则x=____________。
思路解析:原子是呈电中性的,但当原子核外的电子(主要是最外层电子)有了“得”或“失”后,原子中的质子数与核外电子数就不再相等,进而使原子带电,形成了离子。根据所带电荷的电性不同,我们把带正电荷的离子称为阳离子,此时质子数大于电子数,且阳离子所带正电荷数=质子数-核外电子数;我们把带负电荷的离子称为阴离子,此时质子数小于核外电子数,且阴离子所带负电荷数=核外电子数-质子数。
答案:(1)x=y+10 (2)20 8 (3)16
8.(经典回放)下图是几种粒子的结构示意图,观察它们的特征完成下列问题:

(1)属于原子的是________________________。
(2)属于阳离子的是________________________。
(3)属于阴离子的是________________________。
(4)属于稀有气体元素的是________________________。
(5)属于同种元素的是________________________。
(6)属于金属元素的是________________________。
(7)属于非金属元素的是________________________。
思路解析:上述七种结构示意图包含内容丰富,在读懂的基础上再根据上述判断回答问题。
答案:(1)①②③⑤⑦ (2)④ (3)⑥ (4)②?(5)③与④?,⑤与⑥ (6)③④ (7)①⑤⑥
7.(经典回放)根据粒子结构示意图给出的信息,下列说法正确的是( )
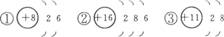
A.①②③表示的是三个原子 B.③表示的元素是非金属元素
C.①③表示的是阳离子 D.①②表示的元素化学性质相似
思路解析:此题根据粒子结构示意图,判断元素种类、粒子种类、元素的性质以及结构的稳定性。解题的关键在于:
(1)由质子数和电子数的差值判断粒子种类(原子、阳离子、阴离子),①②为原子,而③为阳离子。
(2)由核内质子数决定元素种类,核内质子数不同,则表示不同元素。
(3)由原子最外层电子数决定元素的性质,①②为非金属元素,③为金属元素。且最外层电子数相同,性质相似,如①②元素化学性质相似。
(4)由最外层电子数决定粒子结构的稳定性。一般最外层电子数为8的结构称为“8电子稳定结构”。
答案:D
6.某粒子由12个质子、12个中子和10个电子构成,该粒子是
A.分子 B.原子 C.阴离子 D.阳离子
思路解析:此题考查由粒子中质子数、电子数的关系去判断粒子种类的能力。解此题的关键在于要明确判断粒子种类(分子、原子、阴离子、阳离子)的依据是粒子中质子数和电子数的大小。当质子数=电子数时,呈中性,为分子、原子;当质子数>电子数时,带正电荷,为阳离子;当质子数<电子数时,带负电荷,为阴离子。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com