
题目列表(包括答案和解析)
2.以下气体不属于空气污染物的是
A.二氧化氮 B.一氧化碳 C.氧气 D.二氧化硫
1.下列变化中,属于化学变化的是
A.木炭燃烧 B.酒精挥发 C.水结成冰 D.钢铁熔化
|
 2NaCl + 2H2O 2NaOH + Cl2↑+
H2↑
2NaCl + 2H2O 2NaOH + Cl2↑+
H2↑
若电解含氯化钠23.4 t的饱和食盐水,则可制得氢氧化钠多少吨?(写出计算过程)
35.取25 g石灰石样品与一定质量的14.6%的稀盐酸恰好完全反应,将反应所得混合物蒸干得到固体27.2 g(不含结晶水)。设该样品中的杂质既不与稀盐酸反应也不溶于水。试计算:(写出计算过程,计算结果保留一位小数)
(1)该反应中生成的气体的质量。
(2)参加反应的盐酸的质量。
(3)反应后所得溶液中溶质的质量分数。
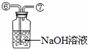
33.(6分)某同学在查阅资料时得知:市售纯碱样品常混有氯化钠杂质。
|

该同学设计了如下图中的装置进行实验,测定市售纯碱样品中碳酸钠的质量分数。(水蒸气的影响忽略不计,夹持装置已略去)

主要实验步骤如下:
①按图组装仪器,并检查装置的气密性;
②称量5.5 g市售纯碱样品放入烧瓶中,加适量蒸馏水溶解,得到试样溶液;
③从分液漏斗滴入稀硫酸,直到不再产生气体时为止;
④缓缓鼓入一定量的N2;
⑤称量B瓶及溶液的质量,发现增重2.2 g。
请回答下列问题:
(1)写出A中发生反应的化学方程式 。
(2)鼓入一定量的N2的目的是 。装置C中澄清石灰水的作用是 。
(3)如果将分液漏斗中的稀硫酸换成浓盐酸,测试的结果(填偏高、偏低或不变) 。
(4)该样品中碳酸钠的质量分数为 %(结果保留到小数点后一位)。
(5)若用与上述实验反应原理不同的实验来测定纯碱样品中碳酸钠的质量分数,请用化学方程式表示实验原理 。
32.(7分)某兴趣小组做了如下实验。
[实验一]提纯NaCl
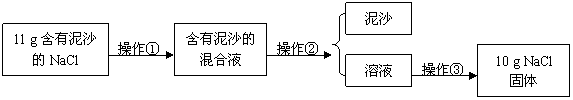

请根据实验回答下列问题:
(1)操作①、②、③依次为下图中的(填序号) 。

(2)若得到NaCl的产率比实际值偏低,则可能的原因是(填序号) 。
A.过滤时滤纸有破损
B.蒸发时有固体溅出
C.蒸发时,看到晶体析出,立即停止加热
D.溶解11 g含有泥沙的NaCl时,加入的水量不足
(3)用上述实验所得的氯化钠配制5%的氯化钠溶液50 g,不需要的仪器为(填序号) 。
A.量筒 B.天平 C.烧杯 D.漏斗 E.蒸发皿 F.玻璃棒 G.酒精灯
[实验二]溶解和结晶KNO3
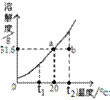 请根据实验和溶解度曲线回答下列问题(水的密度以1 g/mL计):
请根据实验和溶解度曲线回答下列问题(水的密度以1 g/mL计):
|
实验操作 |
实验结果 |
|
取20 mL水,加入5 g KNO3,搅拌,恢复至20℃ |
全部溶解,得溶液① |
|
再加X g KNO3,搅拌 |
恰好饱和,得溶液② |
|
再加5 g KNO3,搅拌 |
得溶液 ③ |
|
加热 |
全部溶解,得溶液④ |
|
冷却至20℃ |
晶体析出,母液⑤ |
(4)③中溶液的质量为 ;一定属于不饱和溶液的是(填数字序号) ;
溶质的质量分数一定相等的是(填序号) 。
(5)析出晶体的质量为(填序号) 。
A.5 g B.X+5 g C.X+10 g
31.(5分)现有下列实验装置示意图:

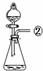
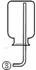

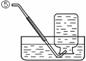

A B C D E F G H
请回答下列问题:
(1)A装置中a仪器的名称是 。
(2)选用A装置可以制备的一种气体是 ,制取该气体的化学反应方程式是 ,收集该气
体可选用的装置为(请填序号,答出一种即可) 。
(3)现有如下资料:
① 制取NO2的反应原理:Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑ +2H2O
② 通常状况下,NO2是一种密度比空气大的有毒气体,能与水发生反应。
③ NO2能与碱溶液反应生成盐和水。
若在实验室中用上述装置制备并收集一瓶干燥的二氧化氮气体,则所选装置从左到右的连接顺序为(填接口序号) 。
30.(7分)甲是初中化学中的常见物质,请根据下列叙述回答问题。
(1)若甲在常温下是液态,可以做一些溶液的溶剂,其75%的溶液常作为医用消毒。则甲的化学式为 ,
它属于(填序号) 。
A.有机物 B.纯净物 C.混合物 D.化合物 E.氧化物
(2)若甲是发酵粉的成分之一,在医疗上是治疗胃酸过多症的一种药剂。
则甲的俗名是 ;甲与盐酸反应的化学方程式为 。
(3)若甲的固体可做气体干燥剂,但不能用于干燥CO2气体,那么甲溶液的pH 7(填“<”或“>” 或“=”),
CO2气体不能被甲干燥的原因可能是 。
(4)若甲物质长期敞口放置会变质,则下列说法正确的是(填序号) 。
A.甲一定是氢氧化钠 B.变质的原因一定是与氧气发生了反应
C.变质后质量一定增加 D.变质一定是由化学反应引起的
29.(6分)下图是有关稀盐酸和氢氧化钠溶液发生化学反应的微观示意图。请回答下列问题:
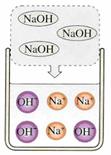
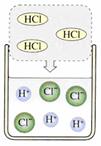

 +
+
A B C
(1)A中溶液能使紫色石蕊溶液显 色,因为其中含有较多的(填粒子符号)_______;
B中溶液能使无色酚酞溶液显 色,因为其中含有较多的(填粒子符号)________。
(2)将50 g 7.3% 的A中的溶液与50 g 8% 的B中的溶液混合,得到C中的溶液,其中主要含有的粒子是(填粒子符号)________;C中的溶液中溶质的质量分数是______ 。
28.(7分)金属的应用非常广泛。
(1)生活中常用铁锅炒菜,主要利用了铁的性质是(填序号) 。
A.导热性 B.导电性 C.延展性 D.有金属光泽
(2)下列能与铁发生反应的是(填序号) 。
A.氧气 B.稀盐酸 C.硫酸铜溶液 D.氯化锌溶液
(3)工业上,常在高温下用一氧化碳把铁从铁矿石中还原出来。若用磁铁矿(主要成分为四氧化三铁)冶炼铁,写出发生反应的化学方程式 。一些铁制品容易生锈。铁制品生锈的条件是 。
(4)某同学在探究金属活动性时做了下列实验:将一条铝片伸入盛有硫酸铜溶液的试管中,开始时没有明显现象,一段时间后,铝片的表面有气泡出现,且有红色固体生成。为了解释此“反常”现象,他查阅资料得知:配制硫酸铜溶液时常加入少量稀硫酸。上述实验中共发生了 个反应,其中产生红色固体物质的化学反应方程式是 。
(5)若向铜和稀硫酸的混合物中滴加过氧化氢溶液,只观察到溶液颜色变蓝,发生反应的化学方程式为 。
27.(5分)物质都是由粒子构成的,化学反应的实质是粒子之间的重新组合。
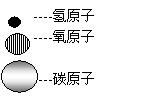
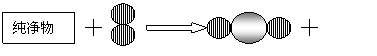
 (1)右图为甲、乙两种不同的气态物质在一定条件下反应生成丙物质的微观示意图,其中
(1)右图为甲、乙两种不同的气态物质在一定条件下反应生成丙物质的微观示意图,其中
 和
和
 分别表示氢原子和氮原子,则可知:
分别表示氢原子和氮原子,则可知:
①一个丙分子由 个原子构成。
②构成甲物质的粒子是 (填“分子”、“原子”或“离子”)。
③此反应中甲、乙、丙三种物质的粒子个数比为 。
|
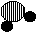 (2)把一定质量的纯净物A和80 g B在一定条件下按下图所示充分反应,当B消耗完时,可生成88 g D物质和18 g E物质。
(2)把一定质量的纯净物A和80 g B在一定条件下按下图所示充分反应,当B消耗完时,可生成88 g D物质和18 g E物质。
回答
请回答下列问题:
①参加反应的A物质的质量是 。
②A分子中各元素的原子个数比是(需表示出元素种类) 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com