
题目列表(包括答案和解析)
2.下面有关分子的说法正确的是 ( )
A.分子是由一种原子组成的
B.分子在化学变化中不能再分
C.分子组成了所有的物质
D.分子是保持物质化学性质的一种微粒
3.含有氧分子的物质是 ( )
A.MnO2 B.CO2 C.KClO3 D.液氧
4.单质分子是由 ( )
A.同种原子构成 B.同一种分子组成
C.同一种元素组成 D.同一种物质组成
5.化合物中一定含有 ( )
A.不同的原子 B.不同的分子
C.不同的元素 D.不同的物质
6.下列关于元素和原子的叙述不正确的是 ( )
A.元素和原子都是构成物质的基本微粒
B.元素是宏观的抽象概念,无数量意义
C.原子是微观的具体实物,有数量意义
D.元素是核电荷数相同的一类原子的总称
7.原子核中肯定含有的微粒是 ( )
A.质子 B.中子 C.电子 D.质子和中子
8.区别纯净物和混合物可以看 ( )
A.元素是否只有一种 B.原子是否只有一种
C.化学式是否只有一种 D.以上都不对
二、选择题(每小题有1-2个选项符合题意)
9.下列元素符号书写错误的是 ( )
A.氟f B.硫S C.钠Na D.铜 Cu
10.O2表示氧气,还可以表示 ( )
①氧元素 ②1个氧分子 ③2个氧元素 ④氧气由氧元素组成 ⑤每个氧分子由2个氧原子构成 ⑥2个氧原子
A.①②③ B.②④⑤ C.②④⑥ D.①④⑥
11.下列说法正确的是 ( )
A.空气是一种元素
B.空气是一种化合物
C.空气是几种化合物的混合物
D.空气是几种单质和几种化合物的混合物
12.下列各组物质中,前者是纯净物,后者是混合物的是 ( )
A.矿泉水和蒸馏水 B.液氧和空气
C.氧化镁和镁 D.糖水和盐水
13.由化学式不能确定 ( )
A.化学式的式量 B.原子个数比
C.元素的质量比 D.微粒的体积大小
14.下列叙述正确的是 ( )
A.SO2分子是由两个氧元素和一个硫元素组成的
B.CO2是由碳单质和氧单质组成的
C.含氧的化合物叫氧化物
D.氧气是由氧分子构成
15.下列物质中不含氧化物的是 ( )
A.空气 B.氯酸钾 C.高锰酸钾的分解产物 D.水
16.化学变化中一定变化的是 ( )
A.元素的种类和数量 B.原子的种类和数量
C.分子的种类和数量 D.物质的状态
17.在相同数目的CO2和SO2分子中,所含一样多的是 (
)
A.氧分子 B.氧原子 C.氧元素 D.化学式式量
18.下列物质中,含氮量最小的是 ( )
A.氯化铵(NH4Cl) B.硝酸铵(NH4NO3)
C.碳铵(NH4HCO3) D.尿素[CO(NH2)2]
19.和nP2O5分子中的氧原子个数相等的是 ( )
A.5n个H2O B.n个NaHCO3 C.5n个O2 D.n个H2SO4
20.某氧化物的化学式为AxOy,化学式量为M,则A的相对原子质量为( )
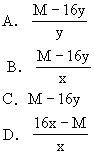 三、填空题
21.用化学符号表示:2个氢原子________,l个氢分子________,3个二氧化硫分子_______,4个五氧化二磷分子________。
22.写出下列物质的名称:KClO3
_________,KMnO4 ________,CuS ________,Fe3O4__________。
23.下列物质中:
(1)NH3 (2)O2 (3)N2
(4)H2SO4 (5)KClO3 (6)MnO2 (7)NaCl (8)H2O
(9)Fe (10)Cu (11)P2O5 (12)CO(NH2)2
(13)CaCO3 (14)HgO
(1)属于单质的是__________;
(2)属于化合物的是________;
(3)属于氧化物的是________。
24.4CO2表示_________,其中含碳原子________个,含氧原子_________个。
25.某物质的化学式是MgX,其中Mg占60%,则X的相对原子质量是__________,X是__________元素。
26.某氮的氧化物中,氮与氧的质量比为7:4,该氧化物的化学式为___________。
四、计算题
27.已知硝酸铵的化学式为NH4NO3,试求:
(l)硝酸铵的式量
(2)硝酸铵中氮元素的质量分数;
(3)硝酸铵中氮、氢、氧三种元素的质量比;
(4)100g硝酸铵跟多少克尿素[CO(NH2)2]的含氮量相等。
28.测得某硝酸铵样品中氮的质量分数为32.9%,求该样品中硝酸铵的质量分数(杂质中不含氮元素)。
三、填空题
21.用化学符号表示:2个氢原子________,l个氢分子________,3个二氧化硫分子_______,4个五氧化二磷分子________。
22.写出下列物质的名称:KClO3
_________,KMnO4 ________,CuS ________,Fe3O4__________。
23.下列物质中:
(1)NH3 (2)O2 (3)N2
(4)H2SO4 (5)KClO3 (6)MnO2 (7)NaCl (8)H2O
(9)Fe (10)Cu (11)P2O5 (12)CO(NH2)2
(13)CaCO3 (14)HgO
(1)属于单质的是__________;
(2)属于化合物的是________;
(3)属于氧化物的是________。
24.4CO2表示_________,其中含碳原子________个,含氧原子_________个。
25.某物质的化学式是MgX,其中Mg占60%,则X的相对原子质量是__________,X是__________元素。
26.某氮的氧化物中,氮与氧的质量比为7:4,该氧化物的化学式为___________。
四、计算题
27.已知硝酸铵的化学式为NH4NO3,试求:
(l)硝酸铵的式量
(2)硝酸铵中氮元素的质量分数;
(3)硝酸铵中氮、氢、氧三种元素的质量比;
(4)100g硝酸铵跟多少克尿素[CO(NH2)2]的含氮量相等。
28.测得某硝酸铵样品中氮的质量分数为32.9%,求该样品中硝酸铵的质量分数(杂质中不含氮元素)。
7.三硝酸甘油酯[C3H5(ONO2) 3]是一种炸药,可因撞击而爆炸,同时产生高温。爆炸按下式进行(式中w、x、y、z为化学计量数):
4C2H5(ONO2)3→wN2 + xCO2 + yH2O + xO2
则w、x、y、z的比值为 。
6.实验室用高锰酸钾制取氧气。
(1)求反应中各物质间的质量比: ;
(2)若要制得8 g 氧气,最少需要高锰酸钾的质量为 g。
拓展探究
5.实验室里用氢气还原氧化铜,当4 g氧化铜被还原时,求参加反应的氢气的质量。
能力提高
3.25 g x g
65:1 = x:3.25 g
x = 211.25 g
答:可制得 H2 211.25 g。
(1) ;
(2) ;
(3) ;
(4) 。
4.下面是某学生做的一道计算题,请指出他的错误:
题目:3.25 g Zn 和足量的盐酸反应制取H2,求可得H2的质量多少?
解:设可得H2的质量为x g。
Zn + HCl== ZnCl + H2↑
65 1
3.将0.1 g 碳在空气中燃烧,生成物的质量( )。
A.大于0.1 g B.小于0.1 g
C.等于0.1 g D.无法确定
2.镁在氧气中燃烧生成氧化镁,这个反应中,镁、氧气、氧化镁的质量比是( )。
A.24:32:56 B.24:32:40
C.48:32:80 D.48:32:64
1.利用化学方程式计算的依据是( )。
A.化学方程式表示了一种化学反应过程
B.化学方程式表示了反应物、生成物和反应条件
C.化学方程式表示了反应前后反应物和生成物的质量关系
D.化学方程式中,各反应物质量比等于各生成物质量比
17.某校课外活动小组模拟工业生产方法,用金属铜粉制取少量的硫酸铜。请根据他们的实验操作,回答下列有关问题
(1)向盛有一定量稀硫酸的烧杯中加入一定量的铜粉。此时铜粉表面是否有气泡?______无____。原因是_气泡很难在铜表面存在_。
 (2)加热烧杯中的稀硫酸和铜粉时,烧杯底部上应该垫上___石棉网___________,原因是_____防止烧杯受热不均而破裂________________。
(2)加热烧杯中的稀硫酸和铜粉时,烧杯底部上应该垫上___石棉网___________,原因是_____防止烧杯受热不均而破裂________________。
(3)若如右图所示(图中加热装置没有画出);将导气管口对着铜粉连续不断的通入氧气。可以观察到的现象为铜粉逐渐减少,直至完全消失。写出此过程中发生反应的化学方程式:__ 2Cu+O2=2CuO__;
CuO+H2SO4 =Cu SO4_+_ H2O___。
(4)将所得到的溶液缓慢加热蒸发,至晶体析出。加热时,除了选用右图所示仪器外,还需要补充玻璃仪器是____玻璃棒_______,其作用为______加快蒸发和防止_________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com