
题目列表(包括答案和解析)
2.把少量物质分别加入到另一物质中,充分搅拌后,可以得到溶液的是
A.碘加入酒精中 B.面粉加入水中 C.高锰酸钾加入汽油中 D.植物油加入水中
1. 下图所示的变化中,属于化学变化的是
下图所示的变化中,属于化学变化的是

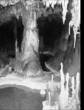

A.钟乳石的形成 B.制取食盐晶体 C.蒸发食盐水 D. 用洗涤剂洗餐具
30. (12分)Ⅰ.纯碱的产量是衡量一个国家化学工业发展水平的重要指标。下面是实验室摸拟侯氏制碱法生产原理的主要过程:
①20℃时,向浓氨水中通入足量的二氧化碳得到NH4HCO3饱和溶液;
②向NH4HCO3饱和溶液中加入食盐细粒,并不断搅拌,直到NaHCO3结晶析出完毕;
③将析出的晶体过滤,得到晶体和滤液,洗涤晶体,然后将晶体充分加热,得到Na2CO3;
④向③的滤液中加入食盐细粒,析出NH4Cl晶体,过滤,得到NH4Cl。
(1)请写出步骤②和③的化学方程式。
②: ▲ ;
③: ▲ 。
(2)侯氏制碱法的优点之一是所得的副产品氯化铵是一种氮肥。该化合物遇碱会生成有刺激性气味的气体 ▲ (写化学式,下同),此气体可使紫色石蕊试液变蓝,以上反应现象可用于检验氯化铵中的阳离子。若要通过实验区分氯化铵和另一种氮肥硝酸铵,常用的试剂是 ▲ 溶液,请比较这两种氮肥中氮元素的质量分数:氯化铵 ▲ 硝酸铵(选填“>”、“<”或“=”)。
Ⅱ.侯氏制碱法所得的纯碱中常含有少量氯化钠,现用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等固定用装置已略去)。
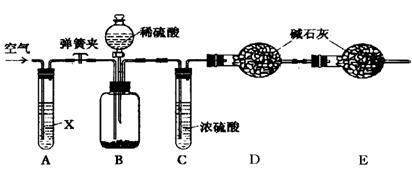
实验步骤如下:
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为83.4g;
③准确称得6.0g纯碱样品放入装置B的广口瓶中;
④打开装置B的分液漏斗旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为85.6g。
试回答:
(1)鼓入空气的目的是 ▲ ,装置A中试剂X最适宜选用 ▲ 。
(2)若没有C装置,则会导致测定结果 ▲ (填“偏大”或“偏小”)。
(3)E装置的作用是 ▲ 。
(4)请根据实验中测得的有关数据,计算纯碱样品中碳酸钠的质量分数。(要求:写出计算过程,结果保留一位小数)
29.(3分)某无色气体中可能含有甲烷、一氧化碳、二氧化碳、氮气中的一种或几种。现将该气体依次缓缓通过下图所示装置,观察到:①A装置内一直未见有浑浊出现;②D装置内无水硫酸铜变蓝(无水硫酸铜遇水变蓝)。最终收集到一定量干燥气体(假设每步反应以及对气体的吸收都是完全的)。
请回答下列问题:
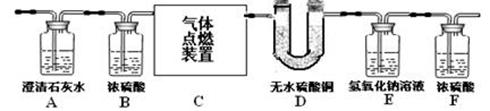
(1)由①可知原混合气体中肯定不含 ▲ (写化学式,下同)。
(2)由②可知原混合气体中一定含有 ▲ 。
|
|
D装置总质量 |
E、F装置总质量 |
|
反应前 |
156.6g |
356.8g |
|
反应后 |
158.4g |
361.2g |
(3)实验过程中记录的实验数据如右表,
则原混合气体的成分为 ▲ 。
28.(6分)某研究性学习小组的同学为了解某地区的地质情况,从实地取回两块样品A和B,进行如下图所示的实验(图中部分反应产物被略去)。

(1)请你根据上图实验现象推断下列物质的化学式。
A: ▲ ;B: ▲ 。
(2)写出下列转化的化学方程式。
E→G: ▲ ;
C→D: ▲ ;
A+G→I: ▲ 。
(3)所加试剂X可能是氧化物、酸、碱、盐中的 ▲ 。
27.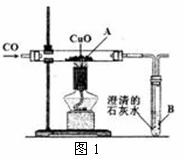 (8分)Ⅰ.小明设计了右图1所示的实验装置,进行一氧化碳还原
(8分)Ⅰ.小明设计了右图1所示的实验装置,进行一氧化碳还原
氧化铜的实验。试回答:
(1)该装置的不足之处是 ▲ 。
(2)实验开始时,先要进行的操作是 ▲ (选填序号:①加热
②通一氧化碳)。
(3)实验过程中,B处反应的化学方程式是 ▲ 。
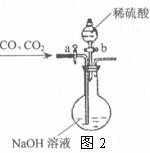 Ⅱ.为分离A装置中反应排出的一氧化碳和二氧化碳,小明又设计了右图2所示的装置(铁架台、铁夹等固定用装置已略去,a、b为活塞)。
Ⅱ.为分离A装置中反应排出的一氧化碳和二氧化碳,小明又设计了右图2所示的装置(铁架台、铁夹等固定用装置已略去,a、b为活塞)。
(1)当关闭活塞b,打开活塞a时,可分离得到 ▲
(写化学式,下同)。
(2)然后关闭活塞a,再打开活塞b,又可分离得到 ▲ 。
Ⅲ.对于A装置中反应后得到的红色固体(此时氧化铜已全部反应完),
小明进行了以下探究。
[查阅资料]①氧化铜经一氧化碳还原不仅能生成铜,还可能生成中间产物氧化亚铜(化学式为Cu2O)。②Cu2O是不溶于水的红色固体,在酸性溶液中,可发生反应生成Cu2+和Cu。
[提出猜想]氧化铜经一氧化碳还原所得到的红色固体中除Cu外还可能含有Cu2O。
[进行实验]小明设计了一个最简单的实验方案。
|
实验步骤 |
▲
|
|
实验现象与结论 |
▲
|
|
化学方程式 |
▲
|
26.(7分)请根据下列实验装置图回答有关问题:
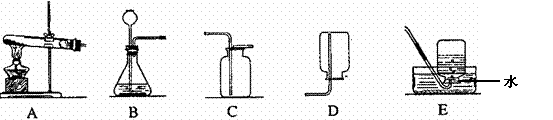
(1)常用实验室制取二氧化碳的化学方程式为 ▲ ,可选用的发生装置和收集装置是 ▲ (填字母),验满方法是 ▲ 。
(2)实验室若用A作为氧气的发生装置,请写出一个对应的化学方程式 ▲ 。
 (3)右图所示装置有很多用途。
(3)右图所示装置有很多用途。
①若用于排空气法收集氢气,氢气应从 ▲ 端(填字母,下同)通入;
②若用于排水法收集氧气时,瓶中先装满水,氧气应从 ▲ 端通入;
③若瓶中储满氮气,用水将氮气排出时,水应从 ▲ 端通入。
25.(5分)自然界中存在着氧循环和碳循环。请回答下列问题。
(1)氟里昂在高空中受紫外线辐射产生Cl原子,Cl原子对臭氧层有破坏作用,其过程可表示为:①Cl+O3→ClO+O2;②ClO+O→Cl+O2。则Cl原子在臭氧反复消耗的过程中充当
▲ (填“反应物”、“生成物”或“催化剂”)。
(2)大气中CO2含量的增加会加剧温室效应。下列反应都能吸收二氧化碳气体,试判断,对维持大气中二氧化碳气体总量平衡至关重要的是 ▲ (填序号)。
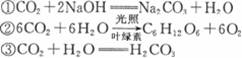
 (3)科学家采取“组分转化”技术,将CO2和H2以一定比例混合,在一定条件下反应生成一种重要的化工原料和水,请完成该反应的化学方程式:2CO2+6H2===1 ▲
+4H2O。
(3)科学家采取“组分转化”技术,将CO2和H2以一定比例混合,在一定条件下反应生成一种重要的化工原料和水,请完成该反应的化学方程式:2CO2+6H2===1 ▲
+4H2O。
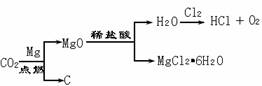
(4)有一种将CO2转化的实验流程(如右图所示),该实验流程中CO2转化的最终产物为
▲ (写化学式,下同),有一种可循环利用的物质是 ▲ 。
24.(4分)小强设计了一个有趣的实验(如右图所示),经过很长一段时间后,他观察到小试管内有晶体析出。
(1)下述是小强对这种现象解释的部分内容,请你帮他把其余的解释内容续写完整:浓硫酸具有吸水性, ▲ 。
(2)若实验前后温度不变,则实验后的硝酸钾溶液的溶质质量分数 ▲ (选填“大于”、 “小于”或“等于”)原饱和硝酸钾溶液的溶质质量分数。
(3)硝酸钾溶液中存在的溶质粒子是 ▲ (写粒子符号)。
(4)硝酸钾常用作化肥,其所属化肥种类是 ▲ 。
23.(4分)元素周期律和周期表是研究化学的重要工具。下表是元素周期表的部分信息。
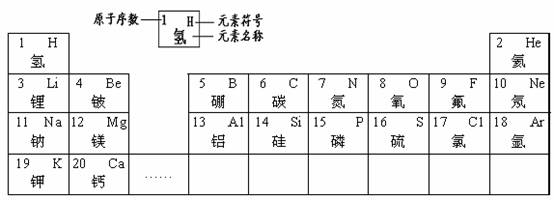
请认真分析表中信息,回答下列问题。
 (1)地壳中含量第二的非金属元素的原子序数是 ▲ 。
(1)地壳中含量第二的非金属元素的原子序数是 ▲ 。
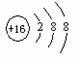
(2) 表示的是 ▲ (写粒子符号)。
(3)由9、20号两种元素组成的化合物是 ▲ (写化学式)。
(4)从原子结构角度看,同一周期元素的原子具有相同的 ▲ 数。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com