
题目列表(包括答案和解析)
3. 已知置换反应:A+B→C+D能够发生
(1)若D为H2,B为稀硫酸,则A的选择应满足的条件是 ,写出一个符合条件的化学方程式 。
(2)当D为Cu,则化合物B可能为 (填化学式),写出两个符合该条件的化学方程式 、 。
(3) 非金属也有活动性顺序,已知溶液中可以发生如下反应:Cl2+2NaBr=2NaCl+Br2,
Br2+2NaI=2NaCl+I2,上述反应属于 ,在Cl2、I2、Br2三种非金属中,活动性最强的是 ,活动性最弱的是 。
答案:1. C。 2. B。
2. 下列物质中,能够直接用金属与盐酸反应制得的是
A.FeCl3 B.MgCl2 C. CuCl2 D. AgCl
3、置换反应和金属活动性顺序
例1 下列反应属于置换反应的是
A.2C+O2 高温 2CO B. C+2CuO 高温 CO2+2Cu
C. C+O2 点燃 CO2 D. CO2+Ca(OH)2==CaCO3↓+H2O
简析:置换反应一定是单质与化合物反应生成另一种单质和另一种化合物的反应,上列4个化学反应中,符合这一条件的只有B。
答案:B。
例2 在托盘天平两端的烧杯内,分别盛有等质量、等质量分数的足量稀硫酸,调节天平到平衡。现向左边烧杯中加入6.5g表面锈蚀的铁钉,同时向右边烧杯中加入6.5g锌粒,在实验过程中,观察到指针偏转的情况可能是
A. 始终向左偏转 B. 不发生偏转
C. 始终向右偏转 D. 最初向左偏转,然后向右偏转
简析:右边烧杯中锌粒直接与酸发生置换反应,放出氢气、质量减小,而左边硫酸先与铁锈反应,不放出气体,此时,天平左边比右边重,指针向左偏转,当表面的铁锈反应完全后,6.5g铁绝大部分是铁、等质量铁和锌与足量酸反应时,铁产生的氢气量多。此时天平指针又向右偏转。
答案:D。
习题:1. 下列化学反应属于置换反应的是
A.CO+CuO 加热CO2+Cu B. Cl2+H2O=HCl+HClO
C. C+H2O 高温 CO+H2 D. Na2O+2HCl=2NaCl+H2O
2. 镁、铁在日常生活中有较为广泛的用途,如:
(1)镁在空气中燃烧时,发出耀眼的白光,可以用来制造镁闪光灯,其反应的化学方程式为 。
(2)市场上出售的补血麦片中常含有微量颗粒细小的还原性铁粉,铁粉与人体胃液中的盐酸反应转化成氯化亚铁,起到补血作用,写出这一反应的方程式 。
答案:1.D。 2. (1)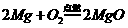 (2)
(2)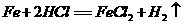
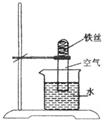
1. 如图所示实验,装置中出现的现象是
A. 铁丝不变化 B. 铁丝逐渐消失
C. 试管中的液面不变化 D. 试管中的液面上升
2. 常见金属的化学性质
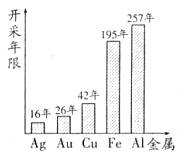 例1 Cu、Fe、Al、Ag、Au是生产、生活中常用的金属,根据有关专家预测,地球上这些资源的蕴量及目前开采能力,这些金属开采的年限如右图所示:
例1 Cu、Fe、Al、Ag、Au是生产、生活中常用的金属,根据有关专家预测,地球上这些资源的蕴量及目前开采能力,这些金属开采的年限如右图所示:
(1)李明同学在对上述金属分类时,他根据金属的某种化学性质相同,将“Au、Cu、X”划分为一类,你认为X是 。
(2)请你写出上述一种金属与AgNO3溶液反应的化学方
程式为 。
(3)王亮同学查阅了以上五种金属还可能开采年限的统计数据,请你结合图示,提出一条金属资源开发利用的合理化建议 。
简析:Au、Cu这两种金属的化学性质均不活泼,因此,X必然也是一种化学性质不活泼的金属,应为Ag。
能与AgNO3反应的金属,其活泼性一定强于Ag,如Cu、Fe、Al等,合理开发金属资源的途经很多,如:合理开采,废旧金属的回收、利用,利用塑料制品代替金属等等。
答案:(1)Ag (2) 2AgNO3+Cu=2Ag+Cu(OH)2等 (3)合理开发矿产,废旧金属的回收、利用,用合成材料代替金属等
例2 远在2500年前,人类已广泛使用铁,下列对铁的叙述中,不正确的是
A. 生铁属于合金 B. 铁可以在氧气中燃烧
 C.
铁能跟硝酸跟溶液反应 D.
铁在潮湿环境中不易生锈
C.
铁能跟硝酸跟溶液反应 D.
铁在潮湿环境中不易生锈
答案:D。
习题:
2. 镁或铝均可制成炊具,说明它们除具有良好的延展性外还具有良好的 性;高层建筑常采用铝合金门窗而不采用铁门窗,原因是 。
答案:1. B 2. 导热;铝密度小,且不易被腐蚀,美观等
1. 食品包装中经常用到铝箔。铝能制成铅箔是因为铝具有良好的
A.导电性 B. 延展性 C. 导热性 D. 抗腐蚀性
6. 金属资源的保护和利用:
(1)铁的腐蚀:
A:铁生锈的环境:铁与O2、水接触
B:原理:4Fe + 3O2 + 2XH2O === 2 Fe2O3·XH2O
1)保持铁制品表面的清洁、干燥
2)表面涂保护膜:如涂油、刷漆、电镀、烤蓝等
3)改变铁的单一结构,制成不锈钢
(2)金属资源的保护:
保护金属资源的途径:
① 防止金属腐蚀
②回收利用废旧金属
③合理开采矿物
④寻找金属的代用
重、难点例题赏析
1 金属材料的物理性质及用途
例1 铝合金因有坚固、轻巧、美观,易于加工等优点,使其成为多数现代家庭封闭阳台时的首选材料。这与铝合金的下列物理性质无关的是
A. 较小的密度 B. 较大的硬度 C. 良好的导电性 D. 较好的延展性
简析:用铝合金封阳台主要利用铝合金的密度小,硬度大以及制作时具有良好的延展性,与铝合金的导电性无关。
答案:C。
例2 综合考虑下表中各方面的因素,回答以下问题:
|
金属 |
全球产量 (104t) |
密度 (103kg·m3) |
熔点 (℃) |
导热性能 |
导电性能 |
市场价格大约 (元/吨) |
|
铝 |
15000 |
2.7 |
660 |
4 |
4 |
1.6×104 |
|
铜 |
8000 |
8.9 |
1083 |
2 |
2 |
1.77×104 |
|
金 |
2 |
19.3 |
1064 |
3 |
3 |
8.8×107 |
|
铁 |
3014300 |
7.9 |
1535 |
8 |
7 |
2.2×103 |
|
铅 |
3000 |
11.3 |
327 |
9 |
9 |
4.9×103 |
|
银 |
8 |
10.5 |
963 |
1 |
1 |
1.37×106 |
上表中导热性、导电性由1-9,由强到弱。
(1)导电性最好的两种金属是 。
(2)你认为导电性能最好的两种金属中,哪种适合做导线?为什么?
(3)为什么用铝锅炒菜时,锅底易变性,而用铁锅则不易为形?
简析:根据表中金属导电性能导电性最好的两种金属是银、铜。根据铜、银的产量、价格、密度可以确定铜更适宜做导线。根据铝、铁的熔点可以知道铝受热易变形。
答案:(1)银、铜 (2) 铜。因为铜的产量比银多,价格比银便宜,密度比银小
(3) 铁熔点高,受热不易变形,铝熔点低,受热易变形。
习题:
5.铁的冶炼:
(1)原料:铁矿石,焦炭,石灰石
(2)冶炼铁的原理:在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来。
 3CO + Fe2O3 2Fe
+ 3CO2
3CO + Fe2O3 2Fe
+ 3CO2
(3)冶炼装置图:如图:
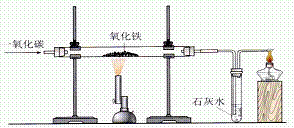
(4) 实验注意事项:
1)先通CO再加热的目的:排出装置内的空气,以免加热时CO与空气混合,可能会发生爆炸。
2)实验完毕后继续通入CO的目的;防止氧化铁被还原成铁后,在较高的温度下重新被氧化
3)尾气的处理:因为CO有毒,所以尾气中的CO气体要经过处理,变成无毒的气体。可点燃使其生成无毒的二氧化碳气体。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com