
题目列表(包括答案和解析)
2.根据化学式计算
根据质量守恒定律,反应前后各元素的质量不变,在这个反应中,铝元素前后质量没有发生变化,因此可以通过铝元素在氧化铝中的质量分数求得。
另外注意:应用第二种方法的前提是反应前某元素存在于一种反应物中,反应后全部转移到一种生成物中。若不是元素反应后不是全部转移到生成物中,只是部分,就不能用此种方法。
典题导考
绿色通道 物质放在空气中加热时,它是和空气中的氧气发生了反应,生成新物质。
典题变式 如图4-12所示为用加热后的玻璃棒点燃白磷,来测定白磷燃烧前后质量的变化情况,用来验证质量守恒定律的实验。
(1)写出白磷燃烧的化学方程式______________________。
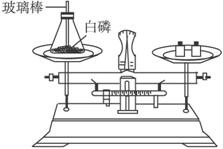
图4-12
(2)白磷在锥形瓶中燃烧时,常常导致瓶塞被冲开,实验失败。导致瓶塞被冲开的原因是_____________________________________________________________。
(3)为了防止瓶塞被冲开,你能将实验做如何的改进?________________________。
(4)实验时,用加热后的玻璃棒点燃白磷,你还能找出其他方法点燃瓶内的白磷吗?________________________。
答案:(1)4P+5O2 2P2O5
2P2O5
(2)白磷燃烧放出大量的热,使瓶内气体体积迅速膨胀,瓶内压强大于外部压强
(3)减小白磷的量,或把锥形瓶放在盛有冷水的烧杯中
(4)因白磷着火点低,可用酒精灯给锥形瓶底部微热来点燃白磷
绿色通道 方程式书写不正确主要有以下几个方面:①化学式书写不正确;②未配平;③未表明反应条件或气体、沉淀符号。
典题变式 下列化学方程式书写正确的是( )
A.H2O2====H2↑+O2↑
B.Fe+O2 Fe3O4
Fe3O4
C.Mg+O2 MgO2
D.4P+5O2
MgO2
D.4P+5O2 2P2O5
2P2O5
答案:D
绿色通道 化学方程式的意义与化学反应微观图示的意义一样,主要是根据思路解析中归纳的八条去理解速写。注意:写信息的题目,信息不可重复,能看出信息,不可不填。
典题变式 由2H2O 2H2↑+O2↑
2H2↑+O2↑
这个化学方程式,你能看出哪些信息?
(1)_____________________________________________。
(2)_____________________________________________。
(3)_____________________________________________。
(4)_____________________________________________。
(5)_____________________________________________。
答案:从例3解析所述任选五条即可,但不得重复。如:
(1)氢气是由氢元素组成的
(2)氧气是由氧元素组成的
这两条是重复的。
1.根据化学方程式计算
题目给出了电解铝的化学方程式,已知反应物氧化铝的质量,求生成物铝的质量。缺少的是在这个反应中氧化铝与铝之间的质量关系,但是我们通过化学方程式可以求得氧化铝和铝的质量比,通过列比例式可以计算得出铝的质量。
2.如何配平化学方程式?
剖析:(1)若方程式中反应物和生成物比较简单,用“观察法”。
(2)若一种元素在方程式两边只出现了一次,原子个数不相等且差别较大,求出不相等原子个数的最小公倍数,用“最小公倍数法”。
(3)若左右两边出现次数较多的某种元素的原子一边为奇数,一边为偶数,则用“奇数配偶法”。
问题探究
问题1 在我们的日常生活和化学实验中,经常使用酒精为燃料来对物质进行加热。酒精的成分是乙醇(化学式为C2H6O),在空气或氧气中燃烧后都生成水和二氧化碳,同时放出大量热。
(1)如果想知道酒精的组成,你应该如何设计实验方案?
(2)你的实验方案还有哪些问题不能解决?
探究:(1)点燃酒精,在火焰上方罩一冷而干燥的烧杯,烧杯内壁上有水雾生成,说明产物有水,生成水则说明酒精中含氢元素。将烧杯迅速倒转过来,向烧杯中倒入澄清的石灰水,石灰水变浑浊,说明产物有二氧化碳,生成二氧化碳则说明酒精中含碳元素。
(2)因酒精燃烧是与氧气发生了反应,产物水和二氧化碳中的氧元素究竟来自于氧气还是酒精不能确定,该实验还不能确定酒精中是否含有氧元素。
问题2 工业上用电解氧化铝的方法制取单质铝的化学方程式为:2Al2O3====4Al+3O2↑。对“电解10 t氧化铝最多生产多少吨铝?”你能有几种方法解决这一问题?
探究1:①解:设最多生产铝的质量为x
2Al2O3 ==== 4Al+3O2↑
204 108
10 t x
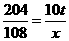
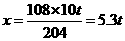
答:最多生产5.3 t铝。
探究2:解:氧化铝中铝元素的质量分数:
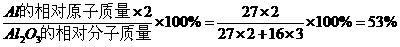
铝的质量为:10 t×53%=5.3 t
答:最多生产铝5.3 t。
典题精讲
例1 (2010武汉课改实验) 某兴趣小组为了探究质量守恒定律,进行了如图所示的小实验。在一根用细铜丝吊着的长玻璃棒两端,分别绕上40 cm长的粗铜线,并使玻璃棒保持水平。然后,用酒精灯给左边一端铜丝加热1.2分钟。停止加热后冷却,仔细观察发生的现象。
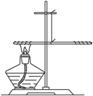
图4-11
(1)冷却后,他们观察到的现象是:
①_______________________________________________________________。
②_______________________________________________________________。
(2)写出铜丝加热时所发生反应的化学方程式___________________________。
思路解析 常温下铜的化学性质稳定,但在加热的条件下易与空气中的氧气反应生成黑色的氧化铜,根据质量守恒定律,生成的氧化铜的质量等于参加反应的铜与氧气的质量之和,因此用酒精灯给左端加热使得左端铜丝质量变大,玻璃棒失去平衡。
答案:(1)①左端铜丝由红色变成黑色 ②玻璃棒左端下沉
(2)2Cu+O2 2CuO
2CuO
例2下列化学方程式书写正确的是( )
A.C+O2====CO2
B.CuSO4+2NaOH====Cu(OH)2 ↓+Na2SO4
C.Fe+O2 2Fe2O3
2Fe2O3
D.2H2O 2H2+O2
2H2+O2
思路解析 判断化学方程式是否正确应从以下几个方面考虑:
(1)反应能否发生,反应是否符合客观事实。
(2)反应物、生成物的化学式是否正确。
(3)化学方程式是否配平。
(4)反应条件是否注明,符号“↓”或“↑”使用是否正确。
该题中,A没有注明反应条件;C中Fe燃烧的生成物是Fe3O4而不是Fe2O3;D中没有在H2和O2后标上“↑”。
答案:B
例3氢气和氧气之间发生化学反应的过程,可用图4-13表示。
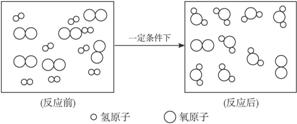
图4-13
试回答下列问题:
(1)写出该反应的化学方程式________________________________________。
(2)除化学方程式本身的意义外,从上图你还能得到哪些信息?(写出两条即可)
①______________________________________________________。
②______________________________________________________。
思路解析 化学反应若用微观图示表示的话,其意义可概括为这样几条:①表示出反应物、生成物和反应条件;②表示出反应物与生成物之间的微粒个数比;③表示出反应物与生成物之间的质量比;④表示出物质的组成;⑤表示出物质的构成;⑥表示出分子的构成;⑦表示出在化学变化中分子可再分,原子不可再分;⑧表示出化学反应前后,原子的种类、数目不变等。
答案:(1)2H2+O2 2H2O
2H2O
(2)上述除前三点外,任选两条。
知识导学
对质量守恒定律的理解应该注意这样几个问题:
(1)质量守恒定律对化学变化有意义,对物理变化无意义。
(2)质量守恒定律指的是“质量”守恒,并不包括其他方面,如反应前后的体积不一定守恒。
(3)不能把“参加反应的各物质”简单理解成“反应物”,因为有些反应物不一定全部参与反应,有“过量”问题。
(4)很多化学反应有气体生成,定律中“生成的各物质的质量总和”包括气体,不能因为生成了气体而误认为质量减少,不符合质量守恒定律。
(5)有些反应有气体参与,定律中“参加化学反应的各物质的质量总和”包括该气体的质量,忘记的话,往往会误认为反应后物质的质量增加了。
质量守恒的原因可以从化学反应的实质上去理解。化学反应的实质是:反应物的分子先分裂成原子,原子再重新结合成生成物的分子。因此,一切化学反应前后,原子的种类、数目、总质量都没改变。所以化学反应中存在质量守恒定律。
为了从宏观和微观角度来理解质量守恒定律,可以将化学反应的过程归纳为:五个不改变,两个一定改变,一个可能改变。
(1)五个不改变:
宏观上:反应物和生成物的总质量、元素种类。
微观上:原子种类、原子数目、原子的总质量。
(2)两个一定改变:
宏观上:物质的种类。
微观上:分子的种类。
(3)一个可能改变:分子的总数。
判断化学方程式是否正确应从以下几个方面考虑:
(1)反应能否发生,反应是否符合客观事实;
(2)反应物、生成物的化学式是否正确;
(3)化学方程式是否配平;
(4)反应条件是否注明,符号“↓”或“↑”使用是否正确。
化学方程式的读法应从含义上来理解:
(1)读取反应物、生成物和反应条件;
(2)读取反应物与生成物之间的微粒个数比(即各物质前的化学计量数);
(3)读取反应物与生成物之间的质量比。
从微观上看,化学反应前后各微粒的个数比是一定的,即一定数目的微粒参加反应,生成一定数目的微粒。这反映到化学方程式就是每种物质化学式前面的化学计量数比是一定的。又由于反应前后各原子的种类、质量、数目不变,因此从宏观上,参加的各物质质量之比就是一定的。
参加反应的各物质质量之比等于各物质的分子质量和物质的化学计量数乘积之比。
通过化学方程式计算需要注意的问题:
(1)未知量包含单位
未知量与在数学中用到的未知数有所不同,它是带有单位的未知数。每个未知量都是包含单位的,所以在设完未知量后,在未知量后面就不要再带单位了。
(2)化学方程式书写要正确
特别要注意两点,一是化学式书写要正确,二是化学方程式要配平。如果这两点中出现错误的话,整个化学方程式就是错误的,会导致后面根据化学方程式的计算是错误的。
(3)列比例式
列比例式,实际体现了参加反应各物质实际质量之比等于化学方程式中的各物质相对质量之比。在列比例时,一定注意乘上前面的化学计量数,如果遗漏,必然导致计算结果的错误。
在解题过程中涉及的实际质量都要带上单位,不管在列比例式时或者最后的计算结果都不要漏掉单位。另外单位要一致,不一致的要进行单位换算。
疑难导析
关键是对质量守恒定律的理解以及学生分析解决问题的能力。根据质量守恒定律,要明确参加化学反应的各物质的质量总和与生成的各物质的质量总和的关系。参加反应的物质和生成的物质都要找全,缺一不可,尤其是有气体参与或有气体生成的反应,计算反应物和生成物的质量时特别容易被忽视。
正确书写化学方程式的前提是先清楚每一步的含义,然后才能写出具体的化学方程式。配平方程式时,没必要特别注意运用什么方法,配平是我们的最终目的,往往一个化学方程式的配平需要我们对几种方法进行糅合。
问题导思
首先分析题目提供的信息是酒精在空气或氧气中燃烧后都生成水和二氧化碳。信息目的是告诉我们:根据质量守恒定律可知化学反应前后元素种类不变。生成水,说明酒精中应含氢元素;生成二氧化碳说明酒精中应含碳元素;因酒精燃烧是与氧气发生了反应,产物水和二氧化碳中的氧元素究竟来自于氧气还是酒精不能确定。原理既然如此,然后设计实验证明酒精的组成,我们只需用实验证明水和二氧化碳的生成就可以了:证明水的生成应在酒精火焰的上方罩一冷而干燥的烧杯,看是否出现水雾;证明二氧化碳的生成应用澄清的石灰水,看石灰水是否变浑浊,这两条是同学们普遍知道的规律。
根据质量守恒定律,乙醇中的氧元素和氧气中的氧元素都参加反应,即使乙醇中不含氧元素,也可以生成水和二氧化碳。
解决此类问题的思路有两个:
1.为什么在实际操作实验的过程中,常常遇到反应物的质量和生成物的质量不相等的情况?
剖析:解决这一疑点,必须全面理解质量守恒定律。有这样两点值得注意:
(1)找全生成物:很多化学反应有气体生成,定律中“生成的各物质的质量总和”包括气体,不能因为生成了气体而误认为质量减少,不符合质量守恒定律。
(2)找全反应物:有些反应有气体参与,定律中“参加化学反应的各物质的质量总和”包括该气体的质量。
4.根据化学方程式的计算
(1) 通过化学方程式进行简单计算的解题步骤。以下题为例:
例:实验室中常用锌和稀盐酸反应制取氢气。实验室需要1 g氢气,需要锌的质量是多少?
解题步骤:
①设未知量
②写出化学方程式
③依化学方程式,找出已知量和未知量之间的关系。
④列比例式求解
⑤写出简明答案
⑥回顾检查:
主要应检查以下几个方面:
a.化学式书写是否正确;b.化学方程式配平是否正确,反应条件、气体、沉淀符号是否有遗漏;c.已知量与未知量关系是否正确;d.解题过程和结果是否正确。
(2) 几种常见的计算类型
①已知反应物(或生成物)的质量,利用化学方程式求生成物(或反应物)的质量。
②根据化学方程式进行含有杂质的物质质量间的计算。不纯物质的质量应转化为纯净物质的质量。
纯净物质的质量=不纯物质的质量×纯净物质的质量分数。
③ 根据化学方程进行含有物质的体积、密度与质量间换算的有关计算。
疑难突破
3.化学方程式
(1)定义:__________________________________________________。
(2)书写原则
①以____________________为依据。
②要遵守____________________。
(3)书写步骤
以磷在空气中燃烧为例,说明书写化学方程式的具体步骤。
①写:写出反应物与生成物的化学式,中间用横线相连。
P+O2--P2O5
②配:配平化学方程式
4P+5O2--2P2O5
③标:标明反应条件和生成物状态“↓”或“↑”
4P+5O2 2P2O5
2P2O5
(4)含义
①表明反应物、生成物和反应条件
②表明反应物与生成物之间的微粒个数比
③表明反应物与生成物之间的质量比
(5)读法
①____________________________________________________________;
②____________________________________________________________;
③____________________________________________________________。
2.质量守恒的原因
从微观上看,化学反应前后______________________________没变,_________没有增减。所以参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
1.质量守恒定律
____________化学反应的各物质的质量总和,等于反应后____________________的各物质的质量总和。
4.5 化学方程式
知识梳理
22.(8分)中考资源网如图,在试管和小气球中分别先加入稀盐酸和一种常见的固体物质,然后将气球中的固体倒入试管中,观察到有气泡产生且气球胀大。中考资源网请依据上述实验回答下列问题:
(1)中考资源网气球中加入的固体物质可能是(至少答出两种不同类型的物质)中考资源网 、 。中考资源网
(2)中考资源网请用简单的实验方法,证明制得的气体的密度比空气大还是小。中考资源网
。中考资源网
北大附中2010届初三化学第七单元综合检测题
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com