
题目列表(包括答案和解析)
4.混合物和纯净物
混合物是由__________组成的,例如________:;纯净物只由___________组成,例如:__________。
疑难突破
3.稀有气体
18世纪中叶以前,人们一直把空气看作是单一成分的物质,1775年,法国化学家用__________定量的方法得出空气是由氮气和氧气组成的结论。1882年,英国物理学家雷利和化学家拉姆赛发现了空气中的__________气体--氩气。
2.空气是一种重要的资源
(1)在工业上利用空气中氧气、氮气、稀有气体的___________不同,采用__________的方法将各种气体分离出来。氧气的沸点__________氮气的沸点。
(2)
|
空气的成分 |
用途 |
|
氧气 |
|
|
氮气 |
|
|
稀有气体 |
|
1.空气的组成和氧气含量的测定
(1)空气的成分按照体积分数计算,氮气约占________%,氧气约占________%,约占0.94%,二氧化碳约占________%,__________约占0.03%。
(2)使用加热铜丝的方法测定空气中氧气的含量时,观察到的主要实验现象是:铜丝变成__________;气体的总体积__________ 。该实验可得出的结论是:空气中氧气的体积约占。
2.1 空气的成分
知识梳理
2.如何计算混合物中某元素质量分数的方法?例如有一不纯的硝酸铵(NH4NO3)样品,经分析知氮元素的质量分数为33.6%(杂质不含氮元素),求样品中硝酸铵的质量分数。
剖析:若设混合物中某化合物的质量分数为a,化合物中某元素的质量分数为b,混合物中某元素的质量分数为c,则它们之间有如下的计算关系:

若已知a、b的值,求c,则其计算方法是:
c=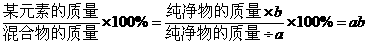
样品中硝酸铵的质量分数=
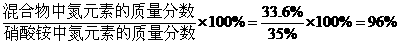
问题探究
问题 在学习化学式的过程中,一学习小组遇到了下面的问题: 160 g三氧化硫所含氧元素与多少克双氧水中所含氧元素的质量相等?
探究:小组内的同学用不同的方法进行了计算探究。
小明同学的计算方案:
解:三氧化硫的相对分子质量=80,其中氧元素的质量分数=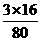 ×100%=60%。双氧水的相对分子质量(H2O2)=34,其中氧元素的质量分数为
×100%=60%。双氧水的相对分子质量(H2O2)=34,其中氧元素的质量分数为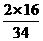 ×100%=94.1%
×100%=94.1%
设160 g三氧化硫与质量为x的双氧水所含的氧元素的质量相等
160 g×60%=x×94.1%
解得:x=102 g
小美同学的计算方案:
2SO3 --6个氧原子--3H2O2
2×80 3×34
160 g x
列出正比例式
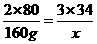 x=102 g
x=102 g
典题精讲
例1 (2010沈阳课改区) 2010年3月,国家质检局查出一些辣椒酱、番茄酱等食品中含有工业染色剂“苏丹红一号”,人食用后可能致癌。“苏丹红一号”的化学式为C16H12N2O,下列有关“苏丹红一号”的说法中正确的是( )
A.“苏丹红一号”属于氧化物
B.“苏丹红一号”由30个原子构成
C.“苏丹红一号”的相对分子质量为248
D.“苏丹红一号”属于有机高分子化合物
思路解析 氧化物是由两种元素组成,其中一种是氧元素的化合物,而“苏丹红一号”是由C、H、O、N四种元素组成的化合物。“苏丹红一号”是由C16H12N2O分子构成,1个C16H12N2O分子是由31个原子构成的。相对分子质量是化学式中各原子的相对原子质量的总和,则C16H12N2O的相对分子质量=12×16+1×12+14×2+16=248。它的相对分子质量比较小,通常称为小分子,而不是有机高分子化合物。
答案:C
例2已知在氮的氧化物中,氮元素与氧元素的质量比为7∶20,求此氧化物的化学式。
思路解析 此题是根据化学式计算各元素的质量比的逆运算。若设氮的氧化物的化学式为NxOy,则列式:14x∶16y=7∶20,x∶y=2∶5,所以其化学式为N2O5。
答案:解:设氮的氧化物的化学式为NxOy
由两元素的质量比列式:14x∶16y=7∶20
解得x∶y=2∶5
该氮的氧化物的化学式为N2O5。
例3 (湖北黄冈中考) 现有①FeO ②Fe2O3
③Fe3O4 ④FeS四种含铁化合物,其含铁元素的质量分数由大到小的排列顺序是( )
A.③>②>①>④ B.①>③>②>④ C.④>③>②>① D.①>②>③>④
思路解析 常规方法是先分别计算出三种铁的氧化物中铁元素的质量分数,然后进行比较大小。简单方法为若将四种物质的化学式变形,使它们的一个“分子”中含的铁原子数相同,然后比较各个“分子”的相对分子质量大小;若“分子”的相对分子质量大,则铁的质量分数小,反之亦然。这种方法更简便。
答案:B
知识导学
化学式是一种表示物质组成的化学符号,或者说是一种表示物质组成的国际通用的化学语言,既然是化学语言,它就具有一定的化学意义。化学式是帮助人们从宏观物质到微观构成之间建立联系的桥梁。虽然化学式是用英文字母组成的,但在读、写和理解化学式的意义时,不能按照英文的语言习惯来理解和运用。
从宏观和微观两个方面理解,宏观主要指物质的种类、元素种类,微观主要指分子、原子。
注意:元素化合价与离子符号表示方法的区别:
|
化合价 |
离子符号 |
|
标在元素符号正上方 |
标在元素符号右上角 |
|
正负号在前,数值在后 |
数值在前,正负号在后 |
|
数值是1时不能省略 |
数值是1时省略不写 |
记忆化合价口诀:
一价钾钠氢氯银,二价钙镁钡锌氧
三价铝四价硅,二三铁,二四碳
二四六硫都齐全,铜汞二价最常见
常见原子团的化合价:
负一硝酸氢氧根,负二硫酸碳酸根
正一价的是铵根。
化学知识之间是有内在规律的,掌握了规律就能驾驭知识,灵活应用知识。本节只要找到书写化学式的一般步骤,就可以根据元素的化合价,应用化合价规则,顺利书写任何一种物质的化学式。书写化学式时,组成元素的排列顺序:金属左,非金属右,氧化物中氧在后。
书写化学式的步骤是:一排序、二标价、三约简、四交叉、五检查。
书写化学式正确顺序的记忆口诀:
正价前,负价后,金属左,非金右,氧化物中氧在后
注意单质的化学式的书写:
一般说,由原子构成的单质,它们的化学式直接用元素符号表示;由分子构成的单质,先写出元素符号,在元素符号的右下角加上数字“2”。
建立数学模型可以使本节的学习更容易。例如,化合物中某元素的质量分数的计算:元素的质量分数反映了一定量的化合物中所含某元素的多少,分析各个量之间的关系后,人们更习惯用百分数的形式来表示,因此建立某元素质量分数计算的数学模型(见左栏(3)))。
在学习时,注意把宏观的物质质量、元素质量和微观的物质组成相联系,才能更好地理解和灵活运用三类计算,解决实际问题。本节中重点学习化合物中某元素的质量分数、各元素的质量比的计算。
疑难导析
必须明确以下两点:(1)化学式前的数字跟化学式中所有元素的原子是否有关系。(2)元素符号前的数字和化学式中元素符号右下角的数字各表示什么含义,元素符号前的数字表示的是什么含义,有无范围限制,化学式中元素符号右下角的数字表示什么含义,受到什么限制,能否改变。
该类型的题目涉及3种质量分数,所以首先要明确这三种质量分数是指:混合物中某物质的质量分数、物质中某元素的质量分数和混合物中某元素质量分数。由左侧的公式可以得到混合物中某物质的质量分数×物质中某元素的质量分数=混合物中某元素质量分数。利用此公式即可解答此类问题。解答此类题目还要注意:①要理清物质之间的从属关系,弄懂问题的实质,才能利用公式快速求解,②只有此混合物中杂质一定不含该元素,才能运用此公式进行计算。
具体解题先弄清哪些是纯净物哪些是混合物,根据它们之间的关系列出计算式,写解题步骤时不要丢掉100%。
问题导思
充分认识并正确理解化学式的含义,利用化学式进行有关计算是做好本题的基础。根据化学式进行有关计算的解题关键是善于先从化学式中找到计量关系,再确定数量关系。
本题用到了以下计算公式:
纯净物的相对分子质量=化学式中各原子的相对原子质量之和
纯净物中某元素质量分数=
纯净物中某元素质量=纯净物质量×纯净物中该元素质量分数
解决此题的关健是正确理解题意。求出三氧化硫中(80 g)所含氧元素的质量,然后求这些氧元素含在多少克双氧水之中,可分别根据二者的相对分子质量进行计算。还可以用关系式法:根据两种化合物中氧元素的质量相等,则氧原子个数也应该相等,观察到SO3与H2O2化学式中原子个数分别为3和2,并不相等,所以在两化学式前分别加化学计量数、即2SO3和3H2O2,然后根据关系式方便求解。
典题导考
绿色通道 搞清楚每个选项中的基本概念,联系题意综合分析。
典题变式 2003年10月16日,我国载人飞船“神舟五号”在预定区域成功着陆,其中运载火箭的主要燃料是偏二甲肼(化学式为C2H6N2)。下列有关偏二甲肼组成的叙述中,正确的是( )
A.偏二甲肼是由2个碳原子、4个氢分子和1个氮分子构成
B.偏二甲肼是由2个碳原子、6个氢分子和2个氮分子构成
C.偏二甲肼是由碳、氢、氮三种元素组成的
D.偏二甲肼中碳、氢、氮三种元素的质量比为1∶4∶1
答案:C
绿色通道 此类题目主要根据有关化学式的计算公式,把要求解的量设为未知数,列出方程式,即可求解。
典题变式 已知X、Y两种元素的相对原子质量之比为7∶2,仅由这两种元素组成的化合物里,X、Y两元素的质量之比为7∶3,若Y元素显-n价,则此化合物中X元素的化合价为___________。
答案: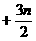
绿色通道 比较同种元素质量分数的大小,除了用先计算后比较的方法外,还有多种方法,如将分子化为相同,比较分母的方法。对于由两种元素组成且元素种类相同的物质,还可以采用比较原子个数比的方法。
典题变式 比较CO(NH2)2、NH4Cl、 NH4NO3、 (NH4)2SO4、NH4HCO3五种物质中氮元素的质量分数由小到大的顺序是____________________________________。
答案:NH4HCO3<(NH4)2SO4<NH4Cl<CO( NH2)2<NH4NO3
1.化学符号“4H2CO3”中“1”“2”“3”“4”各表示什么意义?
剖析:化学式前面加了数字后,使得该符号只有微观意义,没有宏观意义,如2H只表示两个氢原子, 3H2O只表示三个水分子,所以“4”表示4个碳酸分子。化学式中元素 符号右下角的小数字,表示每一个分子中所含该元素原子的个数,所以“1”表示1个碳酸分子含1个碳原子;“2”表示1个碳酸分子中含2个氢原子;“3”表示1个碳酸分子中含3个氧原子。
4.掌握有关化学式的计算
(1)计算物质的相对分子质量
相对分子质量=(各个相对原子质量×原子个数)之和
(2)计算物质组成元素的质量比
化学式中各元素的质量比=各元素的相对原子质量之比×原子个数之比
(3)计算物质中某元素的质量分数
物质中某元素的质量分数=
疑难突破
3.化学式的写法和读法
|
物质类型 |
化学式的写法 |
化学式的读法 |
|
|
单质 |
金属 |
|
|
|
稀有气体 |
|
||
|
非金属 |
固体 |
|
|
|
气体 |
在元素符号的右下角写一小数字表示单质分子中原子个数。如:氧气O2 |
|
|
|
化合物 |
氧化物 |
|
从右向左读作“氧化某”,如:CuO(氧化铜);有时需要读出原子的个数,如:Fe3O4(四氧化三铁) |
|
金属元素和非金属元素组成的化合物 |
非金属元素符号在后,金属元素符号在前。如:ZnS、KCl等 |
|
2.化合价
(1)化合价标在化学式中各元素符号或原子团的正上方,一般把“+”“-”写在前面,价数写在后面。例如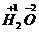 。
。
(2)化合物中,正负化合价的代数和为___________。
(3)化合价的一般规律
①金属元素与非金属元素化合时,金属元素显___________,非金属元素显___________。
②某些元素在不同的物质中可显不同的化合价。
③单质中元素的化合价为___________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com