
题目列表(包括答案和解析)
8.(经典回放)下图是几种粒子的结构示意图,观察它们的特征完成下列问题:

(1)属于原子的是________________________。
(2)属于阳离子的是________________________。
(3)属于阴离子的是________________________。
(4)属于稀有气体元素的是________________________。
(5)属于同种元素的是________________________。
(6)属于金属元素的是________________________。
(7)属于非金属元素的是________________________。
思路解析:上述七种结构示意图包含内容丰富,在读懂的基础上再根据上述判断回答问题。
答案:(1)①②③⑤⑦ (2)④ (3)⑥ (4)②?(5)③与④?,⑤与⑥ (6)③④ (7)①⑤⑥
7.(经典回放)根据粒子结构示意图给出的信息,下列说法正确的是( )
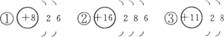
A.①②③表示的是三个原子 B.③表示的元素是非金属元素
C.①③表示的是阳离子 D.①②表示的元素化学性质相似
思路解析:此题根据粒子结构示意图,判断元素种类、粒子种类、元素的性质以及结构的稳定性。解题的关键在于:
(1)由质子数和电子数的差值判断粒子种类(原子、阳离子、阴离子),①②为原子,而③为阳离子。
(2)由核内质子数决定元素种类,核内质子数不同,则表示不同元素。
(3)由原子最外层电子数决定元素的性质,①②为非金属元素,③为金属元素。且最外层电子数相同,性质相似,如①②元素化学性质相似。
(4)由最外层电子数决定粒子结构的稳定性。一般最外层电子数为8的结构称为“8电子稳定结构”。
答案:D
6.某粒子由12个质子、12个中子和10个电子构成,该粒子是
A.分子 B.原子 C.阴离子 D.阳离子
思路解析:此题考查由粒子中质子数、电子数的关系去判断粒子种类的能力。解此题的关键在于要明确判断粒子种类(分子、原子、阴离子、阳离子)的依据是粒子中质子数和电子数的大小。当质子数=电子数时,呈中性,为分子、原子;当质子数>电子数时,带正电荷,为阳离子;当质子数<电子数时,带负电荷,为阴离子。
答案:D
5.(经典回放)下列说法正确的是( )
A.因核外电子质量小,运动速度快,所以核外电子运动状态和宏观物体不同,没有固定的轨道,只有经常出现的区域
B.在多电子的原子里,电子的能量各不相同,能量高的在离核较近的区域里运动
C.最外层只有达到8个电子的结构才是稳定结构
D.金属元素的最外层电子数一定少于4个,非金属元素的最外层电子数一定多于或等于4个,稀有气体元素的最外层电子数一定为8个
思路解析:在多电子的原子里,电子的运动状态与宏观物体不同,没有固定的轨道,电子的能量各不相同,能量低的在离核较近区域里运动,能量高的在离核较远区域里运动。金属元素原子最外层电子数一般少于4个,非金属元素原子最外层电子数一般多于或等于4个,稀有气体元素原子最外层电子数一般为8个,但氦原子最外层只有2个电子,稀有气体元素的原子结构是一种相对稳定结构。
答案:A
4.(经典回放)右图是盐酸滴入氢氧化钠溶液中,有关粒子之间反应的示意图,下列说法错误的是( )

A.盐酸溶液中含有氢离子和氯离子
B.氢氧化钠溶液中含有钠离子和氢氧根离子
C.两种溶液混合时,氢离子与氢氧根离子结合生成了水分子
D.两种溶液混合时,钠离子与氯离子结合生成了氯化钠分子
思路解析:本题同样将微观粒子用图示展现,帮助学生从宏观的角度认识事物、分析问题。解本题可用“排除法”。酸溶于水电离出H+和酸根离子;碱溶于水电离出OH-和金属离子。酸、碱溶液混合发生中和反应,其实质是H+与OH-结合生成了水。A、B、C三个选项都正确。NaCl在溶液中不形成分子,D错。
答案:D
3.核电荷数相同的粒子是( )
A.同一种原子 B.同一种离子
C.同一种分子 D.无法确定
思路解析:仅仅把核电荷数相同的粒子中的“粒子”二字理解为原子,实际上“粒子”包括分子、原子、离子、质子、中子和电子等。例如:甲烷(CH4)分子、氖(Ne)原子、水(H2O)分子、钠离子(Na+),这四种粒子的核电荷数都是10,所以仅凭核电荷数相同这一个条件,无法确定是否为“同一种”粒子。
答案:D
2.元素Mn+的结构示意图为 ,则下列各式正确的是( )
,则下列各式正确的是( )
A.m=2+8 B.m=2+8+n C.m=2+8-n D.m=8+n
思路解析:由结构示意图可知m代表质子数,Mn+为阳离子,它的核外电子总数为2+8。根据阳离子的核外电子数=质子数-离子带电荷数的绝对值,可知质子数=阳离子核外电子数+离子带电荷数的绝对值,故m=2+8+n。
答案:B
1.某粒子的结构示意图为 ,下列说法中不正确的是( )
,下列说法中不正确的是( )
A.该元素原子的原子核外有2个电子层
B.该是一种金属元素
C.该粒子是阳离子
D.该粒子具有稳定结构
思路解析:题给是Al3+的结构示意图,表示的离子是阳离子,具有相对稳定结构,元素为金属元素,但它的原子核外有3个电子层。
答案:A
4.经科学研究发现,元素原子最外层电子数是8或第一层为最外层且电子数为2的原子是很稳定的,而最外电子层电子数是1的元素容易失去这个电子,最外层电子数是7的原子容易得到电子,如果原子最外层电子数是4,其单质在导电方面具有某些特殊的优良性能,如硅原子最外电子层有4个电子,因而常被用作半导体材料。下列可作半导体材料的是( )

思路解析:对本题信息的处理要注意去伪存真,排除干扰。题干中给出了半导体材料原子结构的明显信息,即原子的最外层电子数是4。
答案:C
快乐时光
读小学四年级的弟弟胖得实在不像话,大家常常取笑他。
一天,老师要他们一班同学开始在联络簿上记下“每天帮家里做的事”,弟弟怎么也想不出来,最后只好由妈妈代为填写。她在联络簿上写了:“每天帮家里吃饭”。老师的评语是:“看得出来,你很努力!”
30 分钟训练(巩固类训练,可用于课后)
3.某元素R,其原子结构中M(第3)层电子数是L(第2)层电子数的3/4,则该元素的离子结构示意图是( )

思路解析:根据核外电子排布可知,该原子第三层电子数为8×(3/4)=6。应该得到2个电子。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com