
题目列表(包括答案和解析)
1、(2009·兰州)下列物质的鉴别方法正确的是( )
A.用澄清石灰水鉴别氢气和一氧化碳 
B.用无色酚酞鉴别碳酸钠溶液和氢氧化钠溶液
C.用食盐水鉴别硬水和软水

D. 用水鉴别硝酸铵固体和氢氧化钠固体
3、常用除杂的方法
①常用的物理方法
根据物质物理性质上的差异选择除杂的方法。有过滤、蒸发结晶、降温结晶、蒸馏、分馏、萃取、分液、渗析、升华等方法。
②常用的化学方法
吸收法:常用于气体的净化和干燥,可根据被提纯气体中所含杂质气体的性质,选择适当的固体或溶液作为吸收剂。如Cl2中混有的HCl气体可通过饱和食盐水除去。常用装置是洗气瓶或干燥管(U形管)。
沉淀法:在被提纯的物质中加入适量试剂使其与杂质反应,生成沉淀过滤除去。如硝酸钾中含有的少量硝酸钡,可用适量的硫酸钾除去。
气体法:根据物质中所含杂质的性质加入合适的试剂,让杂质转化为气体除去。如KCl中混有的少量K2CO3,可加适量盐酸除去。
转化法:利用化学反应,加入适当的试剂或采用某种条件(如加热),使物质中的杂质转化为被提纯物质,以正盐、酸式盐间的转化最为常见。如:
NaHCO3 Na2CO3。
Na2CO3。
溶解法:对于固体试剂可选择适当的物质将杂质溶解,然后过滤除去,以杂质为两性物质常见。
[例2](2009·泰州)为了除去物质中的杂质(括号内物质为杂质),所选用试剂和操作方法都正确的是( )
|
|
物 质 |
选用试剂(过量) |
操作方法 |
|
A |
CO2(CO) |
O2 |
点燃 |
|
B |
Cu(Fe) |
稀盐酸 |
加入稀盐酸充分反应后过滤、洗涤 |
|
C |
CuSO4溶液(H2SO4) |
氧化铜 |
加入氧化铜粉末充分反应后过滤 |
|
D |
盐酸(H2SO4) |
硝酸钡溶液 |
加入硝酸钡溶液充分反应后过滤 |
[答案]BC
[解析]CO2中混有CO,无法点燃;Cu不与盐酸反应,而Fe可以和盐酸反应生成可溶性的氯化亚铁;H2SO4与氧化铜反应生成CuSO4;H2SO4和硝酸钡反应会增加新的杂质硝酸。
[规律小结]用化学方法除杂时要注意:①最好不引入新的杂质;②不能损耗或减少被提纯物质的质量③实验操作要简便,不能繁杂。用化学方法除去溶液中的杂质时,要使被分离的物质或离子尽可能除净,需要加入过量的分离试剂,在多步分离过程中,后加的试剂应能够把前面所加入的无关物质或离子除去。
变式训练二
2、常见离子的检验
|
物质 |
检验试剂 |
反应现象 |
结论或化学方程式 |
|
OH- |
无色酚酞试液 |
无色酚酞试液变红色 |
---- |
|
CO32- |
稀盐酸 |
产生使澄清石灰水变浑浊的气体 |
CaCO3+2HCl=CaCl2+H2O+CO2↑ |
|
Cl- |
硝酸银溶液和稀硝酸 |
产生不溶于稀硝酸的白色沉淀 |
HCl+AgNO3=AgCl↓+HNO3 |
|
SO42- |
硝酸钡溶液 |
产生不溶于稀硝酸的白色沉淀 |
H2SO4+Ba(NO3)2=BaSO4↓+HNO3 |
|
NH4+ |
熟石灰 |
有刺激性气味的气体产生 |
2NHCl4+Ca(OH)2= CaCl2+2NH3↑+2H2O |
1、常见气体的检验方法及现象
|
物质 |
检验试剂或方法 |
反应现象 |
结论或化学方程式 |
|
O2 |
带火星的木条 |
木条复燃 |
氧气能支持燃烧 |
|
CO2 |
澄清的石灰水 |
澄清的石灰水变浑浊 |
CO2+ Ca(OH) 2=CaCO3↓+H2O |
|
H2 |
点燃,在火焰上方罩一个冷而干燥的烧杯。 |
烧杯内壁产生水珠 |
2H2+O2点燃2H2O |
|
CO |
点燃,在火焰上方罩一个内壁涂有澄清石灰水的烧杯 |
烧杯内壁变得浑浊 |
2CO+O2点燃 2CO2 |
|
CH4 |
点燃,在火焰上方罩一个冷而干燥的烧杯一会,迅速把烧杯倒过来,向烧杯内注入澄清的石灰水。 |
烧杯内壁有水珠,石灰水变浑浊 |
CH4+2O2点燃 CO2+2H2O |
2、(2009·青岛)正确的操作能保证实验顺利进行。请填写下列有关实验操作中的空格:
(1)用酒精灯给物质加热时,要用酒精灯火焰的_______________;
(2)点燃可燃性气体时,都要先______________________,再点燃;
(3)做细铁丝在氧气中燃烧的实验时,集气瓶底应预先________________;
(4)用量筒量取液体度数时,视线与液体凹液面的最低处的位置关系是_________(填写“俯视”、“仰视”或“保持水平”)。
1、(2009·烟台)正确的实验操作对实验结果、人身安全都非常重要。下列实验操作正确的是( )
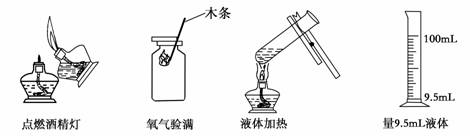



A
B
C
D
2、基本操作
(1)药品的取用
1药品取用的“六不”“两原则”:(1)‘‘六不”:不用手接触药品,不直接闻药品气味,不尝药品味道,对用剩的药品不放回原瓶,不随意丢弃,不拿出实验室(要放入指定的容器中)。(2)“两原则”:取药品时,如果没有说明药品用量,一般应按:固体只须盖满试管底部;液体取1 mL--2 mL。
2取用药品的方法:(1)固体药品的取用:取用粉末状或小颗粒固体药品用药匙或纸槽,步骤:“一斜二送三直立”;取用块状或大颗粒药品用镊子夹取,步骤:“一横二放三慢竖”。 (2)液体药品的取用方法:较多量时用倾倒法,瓶塞倒放,标签向着手心,瓶口紧挨容器口l。取用量少时,用胶头滴管。
(2)酒精灯的使用
使用酒精灯时:①酒精量不超过容器的2/3,也不少于1/3;②不可用燃着的酒精灯去点燃另一盏酒精灯;③酒精灯用完立即用灯帽盖灭,切不可用嘴吹灭;④加热玻璃仪器勿与灯芯接触,要用外焰加热。
(3)物质的加热
1固体的加热:固体试剂常常可以直接加热,盛固体试剂直接加热的仪器有试管、蒸发皿、燃烧匙等。
2液体的加热:(1)盛液体的试管可直接在火焰(外焰)上加热;试管夹夹在离试管口的1/3处;试管内液体的体积不超过试管容积的1/3;试管倾斜,试管口向上且与桌面成45°;管口不能对着有人的方向;先移动试管(或酒精灯)均匀
受热,后集中加热液体的中上部,再慢慢下移加热
(4)托盘天平的使用
称量时,应在两边托盘上放一张质量相同的称量纸,易潮解的药品要放在玻璃器皿中称量;称量前,将游码拨到标尺的“零”处,调节天平平衡;称量时左盘放称量物,右盘放砝码。
(5)量筒的使用
量筒的使用要注意以下几点:1不能加热;2不能用作反应容器;3根据量取液体体积的多少,选择合适的量筒;4读数时,量筒必须放平,视线与液体凹液面的最低处保持水平。
(6)过滤
1仪器:铁架台(带铁圈)、玻璃棒、烧杯、漏斗。
2操作要求:操作时要做到“一贴二低三靠”。
一贴:滤纸的折叠必须和漏斗的角度相符,使滤纸紧贴漏斗内壁,中间不留气泡。
二低:滤纸的边缘须低于漏斗口约5 mm,漏斗内液面略低于滤纸边缘,以防固体混入滤液。
三靠:倒液时,盛装待过滤液体的烧杯嘴和玻璃棒相靠;液体沿玻璃棒流进过滤器,玻璃棒末端和滤纸三层部分相靠;漏斗下端的管口与用来装盛滤液的烧杯内壁相靠;使过滤后的清液成细流,沿漏斗颈和烧杯内壁流人烧杯中。
(7)药品的存放
1广口瓶--固体;细口瓶--液体;集气瓶--气体(密度比空气大,正放;密度比空气小,倒放)。
2遇光、受热易分解的药品用棕色瓶盛(如硝酸、硝酸银溶液);盛碱溶液的试剂瓶应用橡皮塞。
3白磷存放在水中。
4浓硫酸、浓盐酸、浓硝酸、氢氧化钠、氢氧化钙、某些结晶水合物及有毒的化学试剂要密封后妥善保存。
5易燃物、易爆物要远离火源。
(8)实验安全及处置方法
1浓酸流到实验台上:加NaHCO3溶液--水冲洗--抹布擦干。沾在皮肤或衣服上:应先用布拭去,再用大量水冲洗,最后涂上3%.5%的NaHCO3溶液。
2浓碱流到实验台上:加稀醋酸--水冲洗--抹布擦干。沾到皮肤或衣服上:大量水冲洗--涂硼酸溶液。
[例1](2009·泰安)正确的化学实验操作对实验结果、人身安全非常重要。下图中的实验操作正确的是( )
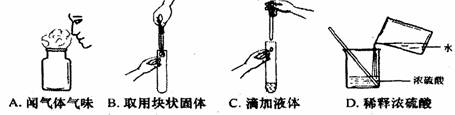

[答案]C
[解析]不能直接闻药品的味道,取用块状固体时,先要把试管横放,放在固体打碎试管底部,稀释浓硫酸时,应把浓硫酸往水里倒。
[规律小结]每个实验基本操作,都有对应的要求及注意事项,操作时一定要严格按照规定,防止发生意外。
变式训练一
1、常用仪器
(1)计量仪器--托盘天平、量筒、胶头滴管。①托盘天平。称量时:左物右码。加砝码:由大到小。精确度:0.1 g。②量筒,用于量取一定体积的液体药品。③胶头滴管,用于吸取和滴加少量液体。

(2)用于加热的仪器。①能在火焰上直接加热的仪器有试管、燃烧匙、蒸发皿、坩埚等;②须垫石棉网间接加热的仪器有烧杯、烧瓶、锥形瓶。
(3)加热器皿--酒精灯、石棉网。
18.CO2;碱;碳酸钙;CaCO3 高温 CaO+CO2↑;CO2+Ca(OH)2 CaCO3↓+H2O
17.(1)④③⑤⑥①② (2)B装置中澄清石灰水变浑浊
Fe2O3+3CO 高温 2Fe +3CO2 Ca(OH)2+CO2 CaCO3↓+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com