
题目列表(包括答案和解析)
3.若要从饱和的氯化钠溶液中获得较多的晶体,下列方法中,你认为最合理的是( )
A.升高溶液的温度 B.蒸发溶剂
C.降低溶液的温度 D.从溶液中倒掉一部分水
解析:氯化钠的溶解度受温度变化影响小,应用蒸发溶剂的方法获得较多的晶体。
答案:B
2.(2010江苏兴化一模,1) 下图所示的变化中,属于化学变化的是( )
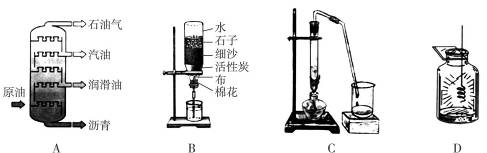
A.石油分馏 B.净化水
C.海水淡化 D.铁丝在氧气中燃烧
解析:化学变化是指有新物质生成的变化,本题选项中只有D项中生成了新物质,其他三项都是将混合物分离。
答案:D
1.海水中含量最多的金属元素是( )
A.K B.Ca C.Mg D.Na
解析:海水中所含盐类中NaCl的含量最为丰富,故含量最多的金属元素应为Na。
答案:D
4.物质的溶解性受外界条件的影响,主要受温度影响。一般来说,大多数固体物质的溶解度随温度升高而____________;例如____________;少数固体物质的溶解度受温度的影响____________,例如____________;极少数固体物质的溶解度随温度升高而____________,例如____________。气体的溶解度随温度升高而____________,随压强的增大而____________。
解析:物质的溶解性随温度的变化关系为:温度升高,固体物质的溶解度一般增大;气体物质的溶解度随温度的升高而降低。
答案:增大 硝酸钾 较小 食盐 减小 氢氧化钙 减小 增大
10分钟训练(强化类训练,可用于课中)
3.下列说法是否正确?正确的,在( )中打“√”,错误的,在( )中打“×”。
(1)100 g水溶解了30 g某物质,则该物质的溶解度为30 g( )
(2)任何物质的溶解度随温度升高都增大( )
(3)饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液( )
(4)饱和溶液析出晶体后,其溶质在整个溶液中的质量分数一定减小( )
(5)温度相同的条件下,同一种物质的饱和溶液比不饱和溶液溶质的质量分数要大一些( )
解析:(1)没有说明温度,也没有说明溶液是否饱和,所以错误。
(2)大多数物质的溶解度随温度升高而增大,少数物质的溶解度随温度升高而减少,如Ca(OH)2。
(3)判断是饱和溶液,还是不饱和溶液要看在某一温度和一定量溶剂中能否再溶解溶质,而浓、稀溶液是指一定量的溶液中含溶质的数量的多少,所以没有必然的联系。
(4)饱和溶液析出晶体后,还是饱和溶液,溶质的质量分数不变。
(5)温度相同的条件下,相同质量溶剂的同一种物质饱和溶液所含溶质较多,不饱和溶液所含溶质较少。
(注:溶液的质量分数是指溶液中的溶质质量占整个溶液总质量的百分比)
答案:(1)× (2)× (3)× (4)× (5)√
2.饱和溶液是指( )
A.浓度较大的溶液
B.还能继续溶解某种溶质的溶液
C.不能再溶解某种溶质的溶液
D.一定温度下,一定量溶剂中不能再溶解某种溶质的溶液
解析:饱和溶液是指一定温度下,一定量的某种溶剂中,对某种溶质不能继续溶解的溶液。但可以继续溶解其他溶质,只是对某一特定溶质不能继续溶解。
答案:D
1.广泛应用于火箭、导弹和飞机制造业的金属镁是从海水中提取的镁盐制取的,这种镁盐是下列( )
A.MgCl2有素 B.Mg(OH)2 C.MgSO4 D.MgCO3
解析:从海水中提取金属镁,通常将石灰乳加入海水或卤水中,沉淀出氢氧化镁,氢氧化镁再与盐酸反应生成氯化镁,电解熔融状态的氯化镁,即可制得金属镁。
答案:A
9.73克10%的盐酸与80克氢氧化钠溶液恰好完全反应。求NaOH溶液中溶质的质量分数和所得溶液中溶质的质量分数。
答案:解:设NaOH质量为x,生成NaCl的质量为y。
NaOH+HCl ==== NaCl+H2O
40 36.5 58.5
x 73 g×10% y
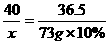 x=8 g
x=8 g
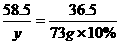 y=11.7 g
y=11.7 g
w(NaOH)=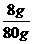 ×100%=10%
×100%=10%
w(NaCl)=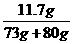 ×100%=7.6%
×100%=7.6%
答:NaOH溶液中溶质的质量分数为10%,所得溶液中溶质的质量分数为7.6%。
8.向40 g 10%的NaOH溶液中加入60 g 20%的NaOH溶液,混匀后取一半溶液,滴入2-3滴无色酚酞试液,然后逐渐滴加10%的稀盐酸,直到溶液的红色刚好褪去。
求:(1)混合后,所得NaOH溶液的质量分数。
(2)中和反应完毕后,所得溶液中溶质的质量分数。
答案:(1)混合溶液中NaOH的质量分数为:(40 g×10%+60 g×20%)/(40 g+60 g)×100%=16%
(2)设参加反应的盐酸溶液质量为x,生成NaCl的质量为y。
NaOH + HCl====NaCl+H2O
40 36.5 58.5
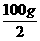 ×16% 10%x y
×16% 10%x y
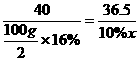 x=73 g
x=73 g
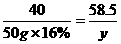 y=11.7
g
y=11.7
g
完全反应后溶液中溶质的质量分数为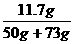 ×100%≈9.51%(或9.5%)
×100%≈9.51%(或9.5%)
答:略
7.某海边化工厂利用海水中含有氯化镁,经过一系列的化学反应生产纯净的氯化镁,主要生产流程如图:

请写出(1)-(4)的操作或生产方法。
思路解析:本题的关键是如何从海水中把镁离子富集并提纯。富集需要生石灰,可以把海水中的镁离子变成沉淀,富集镁元素需要的生石灰,由煅烧石灰石获得。然后根据要求把所得到的氢氧化镁用盐酸溶解后结晶析出。
答案:(1)高温煅烧(2)加水(3)沉淀后富集(收集)(4)加盐酸溶解后结晶,制得无水氯化镁
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com