
题目列表(包括答案和解析)
4.食盐在浓氨水中的饱和溶液比食盐在水中的饱和溶液更容易吸收二氧化碳的原理是______________________________________________________________________________。
答案:二氧化碳遇到食盐在浓氨水中的饱和溶液后与溶液中的NH3·H2O发生反应,生成了易溶于水的(NH4)2CO3
10分钟训练(强化类训练,可用于课中)
3.实验室用食盐制纯碱的操作步骤是:(1)向浓氨水中加入足量食盐晶体制取饱和氨盐水;(2)向饱和氨盐水中通入足量的二氧化碳气体至有大量晶体析出;
(3)将操作(2)中产生的晶体过滤出来;(4)将滤纸上的晶体转移至坩埚中,加热至不再有水蒸气产生,所得固体即为碳酸钠。
对上述信息的有关理解中,正确的是( )
A.用食盐制纯碱还需要含碳元素的物质
B.食盐水比氨盐水更易吸收二氧化碳
C.室温下碳酸氢钠的溶解度比氯化铵的溶解度小,所以先结晶析出
D.在食盐水中如果没有未溶解的食盐晶体存在,说明溶液一定不饱和
答案:AC
2.在发酵面团中加入下列某种物质的溶液揉和,既能除去面团中的酸,又能使蒸出的馒头疏松多孔。这种物质是( )
A.碳酸钠 B.氢氧化钙 C.氧化钙 D.氯化钠
解析:中和酸需要碱性物质,能够使得馒头疏松多孔需要产生气体。符合上述条件的是碳酸钠。
答案:A
1.我国著名化学家侯德榜作出的重大贡献是( )
A.发明黑火药 B.创造湿法冶金
C.改进了纯碱的生产 D.发明了新元素
解析:侯德榜发明的侯氏制碱法,从根本上否定了传统的制碱工艺,改进了制碱设备,使制碱过程更加简便,成本大为降低。
答案:C
18.(2010江苏徐州中考,22) 溶液在生产和科研中具有广泛的用途。在农业上,为了选种子,需要配制15%的盐溶液。现有30 kg食盐固体,可配制食盐溶液____________ kg。配制食盐溶液的一般步骤为①_________________________,②_________________________,③溶解。
解析:根据质量分数公式计算出溶液的质量=30 kg÷15%=200 kg。配制溶液的步骤一般为:①计算;②称量固体和量取液体;③溶解。
答案:200 计算 称量固体和量取液体
快乐时光
饱和溶液
老师:“同学们,饱和溶液中的溶解好像是一辆公交车,而溶质好像是乘客,45个位置已经坐满了,不能再上人了!这就叫饱和了!”
学生:“老师,不对,应该是前门上来一人,后门挤下一个才算饱和了。”
17.(2010山东济宁模拟,14) A、B两种固体物质的溶解度曲线如图所示。请完成下列问题:
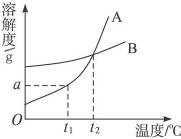
(1)t1℃时,A物质的溶解度为____________ g。
(2)t2℃时,A、B两种物质的溶解度____________(填“相同”或“不同”)。
(3)我国有些地区有一种说法“冬天捞碱,夏天晒盐”。这里的碱是指Na2CO3,盐是指NaCl。那么,图中____________(填A或B)的溶解度曲线与Na2CO3的溶解度曲线相似。
(4)人们用上述方法从盐湖中捞得的Na2CO3会含有少量的NaCl。某研究性学习小组称取含NaCl的Na2CO3固体12.5 g,将其配制成溶液,再向其中逐滴加入足量的稀盐酸,使气体完全放出,共收集到4.4 g CO2气体,则原固体中Na2CO3的质量分数为____________%。
解析:(1)从曲线上可以查出。
(2)两条曲线的交点是指在对应的温度下A、B两种物质的溶解度相等。
(3)Na2CO3的溶解度受温度影响较大,而NaCl较小。
(4)由化学方程式计算出Na2CO3的质量,再计算Na2CO3的质量分数。
答案:(1)a (2)相同 (3)A (4)84.8
16.某海边化工厂利用海水中含有的氯化镁,经过一系列的化学反应,生成纯净的氯化镁,其主要生产过程如下:

请写出上述各步转化的化学方程式:
(1) ______________________________________________________________________。
(2) ______________________________________________________________________。
(3) ______________________________________________________________________。
(4) ______________________________________________________________________。
解析:本题考查物质间的互相关系,对酸、碱、盐、氧化物的通性应熟记。
答案:(1)CaCO3 CaO+CO2↑
CaO+CO2↑
(2)CaO+H2O====Ca(OH)2
(3)Ca(OH)2+Mg====Cl2Mg(OH)2↓+CaCl2
(4)Mg(OH)2+2HCl====MgCl2+2H2O
15.海洋是巨大的资源宝库,从海洋中可提取许多重要物质。请你参与下列探究活动并完成有关问题:
(1)我市某盐场测得:①海水含NaCl约为3.5%(即指溶质氯化钠的质量占整个溶液中质量的百分比为3.5%,下同),②在海边打深井,井水中含NaCl约为8%。晒盐最好选择(填序号)____________作原料,理由是____________________________________________。
(2)关于晒盐原理的说法正确的是____________。
A.利用阳光和风力,使氯化钠蒸发出来
B.利用阳光和风力,使水分蒸发,析出盐
C.降低温度使氯化钠析出
D.日光照晒后,氯化钠的溶解度变小
(3)晒盐后得到的母液(又称卤水)中含有氯化镁(MgCl2)、硫酸镁(MgSO4)和氯化钾(KCl)等物质。参照图中各物质的溶解度曲线,从卤水中提取氯化钾晶体可采用下列方法:
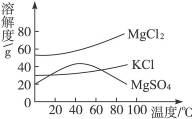
①将卤水加热到60 ℃以上蒸发水分后,会逐渐析出____________(填名称)晶体,其理由是____________________;
②将①中的晶体过滤后,得到滤液,把滤液降温至30 ℃以下,又析出氯化钾晶体,然后用少量的____________(填“热水”或“冷水”)洗涤这两种晶体的混合物,就可以得到较纯的氯化钾晶体。
解析:氯化钠的溶解度受温度影响变化不大,应采用蒸发水分离出晶体。根据曲线图对比几种物质溶解度曲线的不同点后再进行判断。
答案:(1)② NaCl的质量分数大,经土层过滤后污染小 (2)B
(3)①硫酸镁 温度高于60℃时硫酸镁的溶解度随温度升高而减小 ②冷水
14.如图所示,在常温下将一个塑料小球放入盛有饱和食盐水的烧杯中,塑料小球漂浮在食盐水中。

(1)现加入少量食盐晶体,充分搅拌和静置后,在温度不变的情况下,小球在液面沉浮有何变化?____________,并简述理由:________________________________________________。
(2)若要在不用外力的情况下使小球略上浮,你准备采取的具体方法是________________。
解析:饱和食盐水中再加入氯化钠晶体后,晶体不溶解,所以烧杯内溶液的密度不变,小球在液面上的沉浮情况不变。要想使小球上浮,就要设法使其溶液的密度增大。
答案:(1)沉浮情况不变 因为氯化钠晶体加入到氯化钠饱和溶液中,在温度不变的情况下,不会继续溶解,溶液的密度不变,小球排开液体的体积也不变
(2)升高温度后加入氯化钠晶体,使溶液的密度增大(或加入其他可溶性固体物质,如硝酸钾,使溶液的密度增大等)
13.已知20 ℃时KNO3的溶解度为31.6 g,溶解度曲线如图所示。
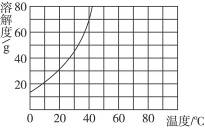
(1)20 ℃时,将25 g KNO3放入到100 g水里,搅拌,得到不饱和溶液。则该溶液中溶质的质量分数为____________。
(2)欲使其变为饱和溶液可采取的方法有:____________或____________或____________。
(3)20 ℃时,将35 g KNO3放入到100 g 水里,搅拌,得到的溶液是(填“饱和”或“不饱和”)____________溶液,该溶液中溶质的质量分数是____________。
解析:(1)依据溶质质量分数公式计算。
(2)不饱和溶液要变为饱和溶液,一般可采用①加溶质;②蒸发溶剂;③降低温度的方法。?
(3)从溶解度曲线可知,20 ℃时35 g KNO3放入到100 g水中KNO3不能全部溶解,得到饱和溶液,再用20 ℃时KNO3的溶解度31.6 g计算:31.6/(100+31.6)×100%=24%。
答案:(1)20% (2)降低温度 蒸发溶剂 增加硝酸钾晶体 (3)饱和 24%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com