
题目列表(包括答案和解析)
6.钢铁行业是国民经济中的基础行业,也是支柱性行业,正因为如此,上世纪五六十年代我国出现过全民大炼钢铁的荒唐的经济闹剧。那么生铁与钢的本质不同在于( )
A.用途不同 B.含碳量不同
C.颜色不同 D.市场需求量不同
解析:生铁和钢都是铁的合金,二者的主要差别在于含碳量不同。
答案:B
5.自然界的矿物含量非常丰富,我国蕴藏了多种自然界稀少的金属矿物。在下列矿物中,不属于金属矿物的是( )
A.石灰石 B.赤铁矿 C.黄铜矿 D.硫磺
解析:石灰石学名碳酸钙,是金属钙的碳酸盐;赤铁矿是三氧化二铁;黄铜矿是铜的硫化物;硫磺是非金属单质。
答案:D
4.面对纷繁复杂的化学变化,如果我们逐个进行学习和研究,时间上不允许,同时也不便于寻找规律,因此有必要对化学反应进行分类学习。下列反应属于置换反应类型的是( )
A.Zn+H2SO4====ZnSO4+H2↑
B.3Fe+2O2 Fe3O4
Fe3O4
C.CH4+2O2 CO2+2H2O D.2HgO
CO2+2H2O D.2HgO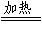 2Hg+O2↑
2Hg+O2↑
解析:置换反应的特征是单质和化合物反应生成新的单质和新的化合物。A项符合。
答案:A
3.铝是生活中最为常见的金属之一。关于铝的“自我保护”能力极强的原因,这一问题引起了同学们的极大兴趣,纷纷提出自己的看法:①铝的化学性质本来不活泼,难被腐蚀;②市场上的铝材料通常是铝合金,合金是不发生化学反应的;③铝性质活泼,表面能产生一层结构致密的氧化膜。你所认同的是( )
A.① B.② C.③ D.①②③
解析:①错误,因为铝的化学性质很活泼;②错误,合金同样能发生化学反应,但合金的机械性能优于纯金属;③正确,由于铝与氧气生成了一层致密的氧化物保护膜,所以铝的性质虽然活泼,但不易于被腐蚀。
答案:C
2.实验和探究是化学学习的重要手段和方法,相信你对身边的许多金属进行过观察和探究,你认为下面说法不正确的一项是( )
A.铜的表面呈现红色,在潮湿的地方放置较长时间会产生铜绿
B.硬币表面是银白色的,它可以导电
C.铅笔芯是用金属铅为主要材料制造的,它是黑色的
D.铁锅通常需要加一个木柄或塑料柄,因为铁的导热性能强
解析:A项正确,因为在潮湿的环境中金属铜容易生锈,即变成“铜绿”;B项正确,硬币本身是由金属组成,可导电;C项错误,制造铅笔芯的材料是石墨而不是铅;D项正确,因为金属导热效果好,加一个木柄或塑料柄,防止烫手。
答案:C
1.下列化学方程式正确的是( )
A.2Fe+6HCl====2FeCl3+3H2↑ B.CuSO4+2NaOH====Cu(OH)2↓+Na2SO4
C.CaCO3+HCl====CaCl+CO2↑+H2O
D.Mg+O2 MgO
MgO
解析:A项中铁与盐酸反应,生成的是FeCl2而不是FeCl3;C项中CaCO3和稀HCl反应生成CaCl2,而不是CaCl;D项中方程式Mg+O2 MgO没有配平。
MgO没有配平。
答案:B
8.(2010江苏徐州中考,25) 小明在学习金属活动性顺序时,对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”这句话产生了好奇。为什么用“一般”这个词呢?难道还有例外吗?
[查阅资料]Na性质活泼,常温下,与氧气反应,也可以与水反应放出氢气。
[实验与分析]①在实验室中,金属钠保存在煤油中;②用镊子从煤油中取出金属钠,放在滤纸上,用小刀切下一小块,投入蒸馏水中,发现钠块立刻熔化成银白色小球,在水面上到处游动,滴入酚酞试液后溶液变成红色;③往硫酸铜溶液中,投入一小块钠,又出现蓝色沉淀,但没有红色物质析出。
(1)金属钠保存在煤油中的原因________________________。
(2)从实验②中,你能得出哪些信息?(任写三条)____________;____________;____________。
(3)写出钠与硫酸铜溶液反应的化学方程式______________________;____________________。
[结论]活动性较强的金属不一定将位于其后面的金属从它们的盐溶液中置换出来,而是置换出H2。
解析:本题为信息给予题,根据金属钠的相关资料,分析金属钠的性质,判断金属钠的保存方法、活泼性、与水反应的产物等,并能写出反应的方程式。金属钠与水反应生成氢气和碱,碱与铜离子反应生成沉淀氢氧化铜,为蓝色沉淀。
答案:(1)防止钠与水、氧气反应
(2)钠为银白色金属、密度比水小、质软、熔点低、反应放热、与水反应的生成物中有碱性物质等合理答案均可
(3)2Na+2H2O====2NaOH+H2↑ 2NaOH+CuSO4====Na2SO4+Cu(OH)2↓
快乐时光
化学课上,老师提问一学生:“如果我把这枚银圆投入稀硫酸中,可以溶解吗?”
学生:“当然不会!”
老师:“为什么呢?”
学生:“如果能够溶解的话,你是舍不得投进去的!
7.镁将成为21世纪重要的轻型环保材料,我国含有非常丰富的镁资源。
(1)占地球表面积70%的海洋是天然的镁元素宝库,从海水中提取镁的流程如下:
海水中的MgCl2 Mg(OH)2
Mg(OH)2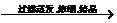 MgCl2·6H2OMgCl2Mg
MgCl2·6H2OMgCl2Mg
①在实验室进行过滤操作时需要用到玻璃棒,其作用是________________________。
②电解熔融氯化镁的过程中,____________能转化为____________能。
(2)①金属镁是一种较活泼金属,在二氧化碳气体中也能燃烧。燃烧的化学方程式为2Mg+CO2====C+2MgO,此反应类型属于( )
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
②金属镁在高温下与氮气反应生成氮化镁,在氮化镁中氮元素的化合价为-3。据此写出
氮化镁的化学式____________________________________。
解析:金属镁从海水中用碱液沉淀得到,经过过滤、溶解、结晶,得到MgCl2·6H2O,除去结晶水,经过电解即可得到该金属元素镁。本题以信息为载体,把金属镁、镁盐等的性质总结起来。
答案:(1)①引流 ②电 化学 (2)①C ②Mg3N2
6.含有硝酸锌、硝酸镁、硝酸铜、硝酸银四种溶质的溶液中加入一定量的铁粉,充分反应后过滤,滤纸上一定有________________________,滤液中一定有____________;如果滤纸上有铜,则滤纸上一定也有________________________,滤液中一定有____________,滤液中一定没有____________;如果滤纸上有铁,则滤纸上一定同时还有____________,滤液中一定有____________________________________。
解析:活泼金属可以置换出不活泼的金属单质。故充分反应后溶液中存在的是最不活泼的金属银单质;滤液中一定存在硝酸亚铁和没有反应的硝酸锌和硝酸镁;如果铜被置换出来,那么银也一定被置换出来了;滤液中一定存在硝酸亚铁和没有参加反应的硝酸锌和硝酸镁;滤液中一定没有硝酸银和硝酸铜。
答案:银 硝酸亚铁、硝酸镁、硝酸锌 银 硝酸亚铁、硝酸镁、硝酸锌 硝酸银 银和铜 硝酸亚铁、硝酸镁、硝酸锌
5.写出下列变化的化学反应方程式。
(1)用砂纸打磨过的铝片放置在空气中______________________________________________。
(2)铁钉在稀硫酸溶液中__________________________________________________________。
(3)铁丝浸泡在硫酸铜溶液中______________________________________________________。
解析:本题考查几种金属的基本性质。砂纸打磨过的铝片,暴露在空气中的是金属铝,被空气中的氧气氧化生成氧化铝。铁钉在稀硫酸中反应,生成硫酸亚铁放出氢气。铁丝浸泡在硫酸铜溶液中,与硫酸铜发生置换反应,生成硫酸亚铁。
答案:(1)4Al+3O2====2Al2O3 (2)Fe+H2SO4====FeSO4+H2↑ (3)CuSO4+Fe====FeSO4+Cu
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com