
题目列表(包括答案和解析)
0.8x 6.4克 y
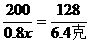 ,x=12.5克
,x=12.5克
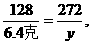 y=13.6克
y=13.6克
7.火力发电厂用石灰石泥浆吸收废气中的二氧化硫以防止污染环境,其反应方程式为:2CaCO3(粉末) + 2SO2+ O2====2CaSO4+ 2CO2。
(1)若100克废气中含6.4克二氧化硫,则处理100克这种废气需含碳酸钙(CaCO3)的石灰石__________克。
(2)处理上述100克废气,可得到含CaSO4 85%的粗产品_________克。
思路解析:题中给出的化学方程式,即为计算的依据。
设需含CaCO3 80%的石灰石的质量为x,生成纯CaSO4的质量为y。
2CaCO3+2SO2+O2====2CaSO4+2CO2
200 128 272
36.5×10% x
x=4 g
污水中所含NaOH的质量分数为: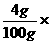 100%=4%。
100%=4%。
答案:(1)4 g(2)4%
36.5 40
6.(2010福建福州中考,30)某综合实践活动小组同学,对我市某化工厂排放的污水进行检测,发现主要的污染物为氢氧化钠。为测定污水中氢氧化钠的含量,取100 g污水于烧杯中,加入36.5 g质量分数为10%的稀盐酸恰好完全反应。(假设污水中其他成分不与稀盐酸反应,反应的化学方程式为:HCl+NaOH====NaCl+H2O)
求:(1)100 g污水中含氢氧化钠多少克?
(2)污水中所含氢氧化钠的质量分数。
思路解析:设100 g污水中含NaOH质量为x。
HCl+NaOH====NaCl+H2O
5.小强同学前往当地的石灰石矿区进行调查,他取回了若干块矿石样品,对样品中碳酸钙的质量分数进行检测,采用的办法如下:取用8 g这种石灰石样品,把40 g稀盐酸分4次加入,测量过程所得数据见下表(已知石灰石样品中含的杂质不溶于水,不与盐酸反应)。请计算:
(1)8 g石灰石样品中含有杂质多少克?
(2)样品中碳酸钙的质量分数是多少?
(3)下表中m的数值应该为多少?
|
序号 |
加入稀盐酸质量/g |
剩余固体质量/g |
|
第1次 |
10 |
5.5 |
|
第2次 |
10 |
m |
|
第3次 |
10 |
1.2 |
|
第4次 |
10 |
1.2 |
(4)要得到280 kg CaO,需要质量分数为80%的石灰石多少千克?(化学方程式:CaCO3 CaO+CO2↑)
CaO+CO2↑)
思路解析:(1)8 g石灰石样品中含有杂质为1.2 g。
(2)样品中碳酸钙的质量分数=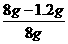 =85%。
=85%。
(3)m=5.5 g-(8 g-5.5 g)=3 g。
(4)设需要80%的石灰石的质量为x。
CaCO3 CaO + CO2↑
CaO + CO2↑
100 56
x×80% 280 kg
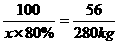 625 kg
625 kg
此题通过不断改变所加入的稀盐酸的质量,观察剩余固体的质量来判断稀盐酸何时不足,石灰石中CaCO3何时完全反应。由表中数据可知,在第三次加入10 g盐酸后,固体剩余物质量不再减少,说明剩余的1.2 g固体不和稀盐酸反应,应为杂质。然后,用8 g石灰石样品质量-杂质质量=CaCO3质量。再除以样品质量,即可求出样品中碳酸钙的质量分数。第(3)问也可从题意得出正解,即第一次加10 g酸时固体的质量减少应和第二次一样,所以第二次剩余的固体质量就是3 g。最后一问可利用含杂质问题的解题方法处理。
答案:(1)1.2 g (2)85% (3)3 (4)625 kg
4.中国登山协会为纪念我们首次攀登珠穆朗玛峰成功50周年,再次组织攀登珠穆朗玛峰活动。阿旺扎西等一行登山运动员成功登顶。假如每位运动员冲顶时消耗自带的液氧4.8 g。求:
(1)这些氧气在标准状况下的体积是多少升?(标准状况下氧气密度为1.43 g·L-1)
(2)若在实验室用高锰酸钾为原料制取相同质量的氧气,需要多少千克的高锰酸钾?
(3)用这种方法给登山运动员供氧,是否可行?简述理由。
解答:(1)4.8 kg氧气在标准状况下的体积为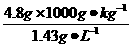 =3 356.6 L。
=3 356.6 L。
(2)设需要高锰酸钾的质量为x。
2KMnO4 K2MnO4+ MnO2+O2↑
K2MnO4+ MnO2+O2↑
316 32
x 4.8 kg
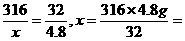 47.4 kg
47.4 kg
(3)不行。此法成本太高,经济上不合算;或在实验室制如此多氧气,耗时太长。
此题难度不高,主要考查学生有关化学方程式计算的两个重要的注意点:(1)气体体积和气体质量的换算(即气体体积=气体质量÷气体密度);(2)化学方程式中单位的换算,如题目中出现“kg”与“g”之间的换算。此题中不仅仅是一道有知识背景的简单计算,还考查了学生在物质制备时是否考虑原料成本和反应时间的因素。
3.(经典回放)只含铜和氧两种元素的固体样品9.0 g,测得铜的质量为8.0 g。已知铜的氧化物有CuO和Cu2O,下列说法正确的是( )
A.固体样品的组成只有两种情况
B.固体样品一定是CuO与Cu2O的混合物
C.固体样品可能是Cu2O
D.若固体样品由两种物质组成,则其中一种质量分数为4/9
思路解析:本题主要考查学生根据元素和元素的质量比判断物质组成的能力。由铜和氧两种元素组成的固体有以下几种情况:①只为CuO②只为Cu2O③CuO与Cu2O的混合物④CuO与Cu的混合物⑤Cu2O与Cu的混合物⑥CuO、Cu2O、Cu三种物质组成的混合物。又因为固体样品中铜为8 g,氧为(9 g-8 g)=1g,而CuO中m(Cu)∶m(O)=4∶1,Cu2O中m(Cu)∶m(O)=8∶1。若固体样品由两种物质组成,则上述组合中③、⑤不成立,④的组合中CuO质量为5 g,Cu的质量为4 g。综合可知选项C、D正确。本题的D选项属难点,若不能将固体样品组合,进行定量分析,则易得出错误结论。
答案:CD
2.已知A物质发生分解反应生成B物质和C物质,当一定量的A反应片刻后,生成56克B和44克C;则实际发生分解的A物质的质量为( )
A.12克 B.44克 C.56克 D.100克
思路解析:根据质量守恒定律,实际发生分解的A物质的质量等于分解后生成的物质B和C的质量总和。即物质A的质量等于56克+44克=100克。
答案:D
1.已知A物质与B物质反应生成C物质,现有12克A与32克B恰好完全反应,则生成C物质的质量是( )
A.44克 B.32克 C.22克 D.12克
思路解析:根据质量守恒定律:反应物A和B的总质量等于生成物C的总质量。32 g+12 g=44 g。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com