
题目列表(包括答案和解析)
6.法轮功邪教组织头目李洪志说,他通过发功能使铝发生化学反应,变成铜和金。请根据化学知识来判断正误,并说明你的理由。
答案:他的观点是错误的。根据化学反应的本质,一切化学变化里,反应前后原子的种类、数目没有改变,质量也基本不变。铝是由铝原子构成,铜是由铜原子构成,金是由金原子构成的。所以铝原子无法通过化学变化生成金原子和铜原子。所以李洪志的说法是伪科学的,纯属歪理邪说。
5.(2010山东邹城中考模拟)小强同学前往当地的石灰石矿区进行调查,他取回了若干块矿石样品,对样品中碳酸钙的质量分数进行检测,采用的办法如下:取用8 g这种石灰石样品,把40 g稀盐酸分4次加入,测量过程所得数据见下表(已知石灰石样品中含的杂质不溶于水,不与盐酸反应)。请计算:
(1)8 g石灰石样品中含有杂质多少克?
(2)样品中碳酸钙的质量分数是多少?
(3)下表中m的数值应该为多少?
|
序号 |
加入稀盐酸质量/g |
剩余固体质量/g |
|
第1次 |
10 |
5.5 |
|
第2次 |
10 |
M |
|
第3次 |
10 |
1.2 |
|
第4次 |
10 |
1.2 |
(4)要得到280 kg CaO,需要质量分数为80%的石灰石多少千克?(化学方程式:CaCO3 CaO+CO2↑)
CaO+CO2↑)
思路解析:(1)8 g石灰石样品中含有杂质为1.2 g。
(2)样品中碳酸钙的质量分数= =85%
=85%
(3)m=5.5 g-(8 g-5.5 g)=3 g
(4)设需要80%的石灰石的质量为x
CaCO3 CaO+CO2↑
CaO+CO2↑
100 56
x×80% 280kg
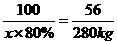
x=625 kg
此题通过不断改变所加入的稀盐酸的质量,观察剩余固体的质量来判断稀盐酸何时不足,石灰石中CaCO3何时完全反应。由表中数据可知,在第三次加入10 g盐酸后,固体剩余物质量不再减少,说明剩余的1.2 g固体不和稀盐酸反应,应为杂质。然后,用8 g石灰石样品质量-杂质质量=CaCO3质量。再除以样品质量,即可求出样品中碳酸钙的质量分数。第三小问也可从题意得出正解,即第一次加10 g酸时固体的质量减少应和第二次一样,所以第二次剩余的固体质量就是3 g。最后一问可利用含杂质问题的解题方法处理。
答案:(1)1.2 g (2)85% (3)3 g (4)625 kg
4.(2010山东菏泽中考模拟)中国登山协会为纪念我们首次攀登珠穆朗玛峰成功50周年,再次组织攀登珠峰活动。阿旺扎西等一行登山运动员于2003年5月21日13:40成功登顶。假如每位运动员冲顶时消耗自带的液氧4.8 kg。求:
(1)这些氧气在标准状况下的体积是多少升?(标准状况下氧气密度为1.43 g·L-1)
(2)若在实验室用高锰酸钾为原料制取相同质量的氧气,需要多少千克的高锰酸钾?
(3)用这种方法给登山运动员供氧,是否可行?简述理由。
思路解析:此题难度不高,主要考查学生有关化学方程式计算的两个重要的注意点:(1)气体体积和气体质量的换算(即气体体积=气体质量÷气体密度);(2)化学方程式中单位的换算,如题目中出现“kg”与“g”之间的换算。此题不仅仅是一道有知识背景的简单计算,还考查了学生在物质制备时是否考虑原料成本和反应时间的因素。
(1)4.8 kg氧气在标准状况下的体积为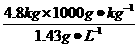 =3 356.6 L
=3 356.6 L
(2)设需要高锰酸钾的质量为x
2KMnO4 K2MnO4+ MnO2+ O2↑
K2MnO4+ MnO2+ O2↑
316 32
x 4.8 kg
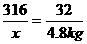
x=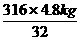 =47.4 kg
=47.4 kg
答案:(1)3 356.62 (2)47.4 kg (3)不行。此法成本太高,经济上不合算;或在实验室制如此多氧气,耗时太长。
3.实验室用16 g纯净的氧化铜与氢气发生反应,经过一段时间在反应未完全时就停止实验,冷却后试管中剩下的固体质量为A g,把该固体跟足量盐酸充分反应,过滤并干燥后得红色固体物质B g。已知,A-B=10,实验中有多少克铜生成?(提示:CuO+2HCl====CuCl2+H2O,CuCl2溶于水,Cu与稀盐酸不反应)
思路解析:由题意知剩下的A g固体包括①未反应的氧化铜,②生成的铜。红色固体物质B g为铜。又因为A-B=10,此10 g为未反应的氧化铜,且CuO与足量稀HCl反应生成的CuCl2溶于水,所以与氢气反应的氧化铜的质量为:16 g-10 g=6 g
根据质量守恒定律,实验中生成的铜的质量为: 6 g×Mr(Cu)/Mr(CuO)×100%=6 g×80%=4.8 g。
答案:4.8 g
2.已知A物质发生分解反应生成B物质和C物质,当一定量的A反应片刻后,生成56克B和44克C。则实际发生分解的A物质的质量为( )
A.12克 B.44克 C.56克 D.100克
思路解析:根据质量守恒定律,实际发生分解的A物质的质量等于分解后生成的物质B和C的质量总和。即物质A的质量等于56克+44克=100克。
答案:D
1.已知A物质与B物质反应生成C物质,现有12克A与32克B恰好完全反应,则生成C物质的质量是( )
A.44克 B.32克 C.22克 D.12克
思路解析:根据质量守恒定律:反应物A和B的总质量等于生成物C的总质量。32克+12克=44克。
答案:A
5.在化学反应3X+4Y====2Z中,已知X和Z的相对分子质量分别是32和102,则Y的相对分子质量为_________。
思路解析:此题是根据质量守恒定律确定Y的相对分子质量。解题时,首先要确定4Y的值,即3×32+4Y=2×102 4Y=2×102-3×32=108 Y=27
答案:27
快乐时光
测谎器
爸爸有一个测谎器,他问德华:“你今天数学成绩如何呢?”
德华回答道:“A”。测谎器响了!
德华又说:“B”。机器也响了!
德华又改说:“C”。机器又响了!
爸爸很生气地叫道:“我以前都是得A的!”
这时,测谎机却翻倒了!
30分钟训练(巩固类训练,可用于课后)
4.蜡烛燃烧后的产物有二氧化碳和水,由质量守恒定律可知,石蜡的组成中一定含有___________、___________元素(填写元素名称)。
思路解析:根据质量守恒定律的微观含义,即“三不变”原则:反应前后原子(或元素)种类不变,原子数目不变,原子质量不变。产物中存在C、H两种元素,反应前石蜡中也一定含有C、H两种元素,至于氧元素,需定量计算后才可确定。
答案:氢 碳
3.已知在反应3A+2B====2C+D中,反应物A、B的质量比为3∶4。当反应生成C和D的质量共140 g时,B消耗的质量为__________g。
思路解析:此题能根据质量守恒定律,由于生成物C和D的质量共140 g,所以A和B的质量之和也应为140 g。由于反应物A、B的质量比为3∶4,则可将物质总质量视为7份(3+4=7),A占其中3份,B占其中4份。所以消耗B的质量为140 g÷7×4=80 g。
答案:80
2.氯酸钾和二氧化锰的混合物共A克,加热完全反应后得到B克氧气和C克氯化钾,则混合物中二氧化锰的质量为( )
A.(A+B-C)克 B.(A-B-C)克 C.(A+B+C)克 D.(A+C)克
思路解析:根据质量守恒定律,二氧化锰质量在反应前后不变,氧气和氯化钾的总质量等于反应前氯酸钾的总质量。即氯酸钾的总质量=(B+C)克,二氧化锰的质量=A克-(B+C)克=(A-B-C)克。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com