
题目列表(包括答案和解析)
14.已知液氨的性质与水相似,25℃时,NH3+NH3 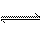 NH4++NH2-,NH4+离子的平衡浓度为1×10-15mol/L,则下列说法中正确的是 ( )
NH4++NH2-,NH4+离子的平衡浓度为1×10-15mol/L,则下列说法中正确的是 ( )
A.在液氨中加入NaNH2可使液氨的离子积变大
B.在液氨中加入NH4Cl可使液氨的离子积减小
C.在此温度下液氨的离子积为1×10-30
D.在液氨中放入金属钠,可生成NaNH2
13.在常温下,pH = 9的NaOH溶液和CH3COONa两种溶液中,假设由水电离产生的OH─离子浓度分别为a和b,则a与b的关系为 ( )
A.a>b B.a=10-4b C. b =10-4 a D.a=b
12.取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则该原溶液的浓度为 ( )
A.0.01mol·L-1 B.0.017mol·L-1 C.0.05mol·L-1 D.0.50mol·L-1
11.关于水的离子积常数Kw与水的电离平衡常数Kc的叙述中,正确的是 ( )
A.Kw和Kc都随温度的升高而增大 B.Kw和Kc数值不同,但单位相同
C.Kw和Kc数值相同,但单位不同 D.Kw和Kc数值和单位都不同
10.为更合理地表示溶液的酸碱性,科学家提出“酸度”(用AG表示)概念,AG=lg[c(H+)/c(OH-)].下列叙述中正确的是 ( )
①任何温度下,纯水的AG等于0; ②溶液的AG越小,酸性越强;
③常温下,0.1mol/L盐酸的AG=12; ④25℃时,某溶液的AG=-10,其pH=10.
A.①③ B.②④ C.①② D.③④
9.常温下,某溶液中由水电离出来的c(H+)=1.0×10-13mol·L-1,该溶液可能是 ( )
①二氧化硫 ②氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液
A.①④ B.①② C.②③ D.③④
8.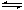 水的电离过程为H2O H+ + OH─,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14,则下列叙述正确的是 ( )
水的电离过程为H2O H+ + OH─,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14,则下列叙述正确的是 ( )
A.[H+]随温度的升高而降低 B.水的电离过程是吸热的
C.水的电离平衡常数与浓度、温度有关 D.在35℃时,[H+] > [OH─]
7.要使饱和H2S溶液pH增大的同时,[S2─]减小,可向溶液中加入适量 ①NaOH溶液;②水;③SO2;④CuSO4固体;⑤盐酸 ( )
A.①③⑤ B.②④⑤ C.②③ D.③④⑤
6.下列事实能说明HNO2是弱电解质的是 ( )
A.NaNO2溶液的pH大于7 B.用HNO2溶液做导电实验灯泡很暗
C. HNO2溶液不与硫酸钠反应 D. HNO2易分解产生NO、NO2
5.下列物质的溶液加热蒸干、灼烧后,所得的固体成份不相同的是 ( )
A.FeCl2、FeCl3 B.NaHCO3、Na2CO3
C.NaAl(OH)4、AlCl3 D.Mg(HCO3)2、MgCl2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com