
题目列表(包括答案和解析)
2. 除第一周期外,关于同周期主族元素的下列变化规律的叙述中不正确的是 ( )
A、从左到右,原子半径逐渐减小
B、从左到右,元素单质的氧化性减弱,还原性增强
C、从左到右,元素最高正将数从+1递增到+7,负价由-4递变到-1(O、F除外)
D、从左到右,元素最高价氧化物对应水化物碱性减弱,酸性增强
1.钢铁发生吸氧腐蚀时,正极发生的电极反应是( )
A.2H+ +2e- → H2 ↑ B.Fe2+ + 2e- →Fe
C.2H2O +O2 +4e- →4OH- D.Fe3+ +e- → Fe2+
27.(6分,每空1分)已知乙烯发生如下变化:
|
|


(1)分别写出B的名称 和有机物C 的名称
(2)写出反应①的化学方程式 该反应的类型是
(3)写出反应②的化学方程式 该反应的类型是
28.(6分,每空2分)已知丙烯与氯化氢的反应原理如下:
主反应:CH2=CHCH3 + HCl → CH3CHClCH3(主要产物);
副反应:CH2=CHCH3 + HCl → CH2ClCH2CH3(副产物)
现有化合物A的分子式为C4H8,能使溴的四氯化碳溶液褪色,也能使高锰酸钾溶液褪色。1molA与1mol HCl作用可生成两种产物,其主产物B也可以从A的同分异构体C与HCl作用得到。C既能使溴的四氯化碳溶液褪色,又能使高锰酸钾溶液褪色。试写出A、B、C的结构简式。
A ;B ;C ;
沈阳二中2010-2011学年度下学期6月月考
26.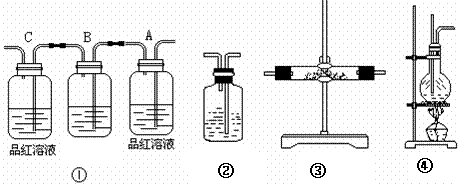 实验室利用图④来制乙烯时, 常因温度过高而发生副反应。部分乙醇跟浓硫酸反应生成二氧化硫、二氧化碳、水蒸气和炭黑。请用下列编号为①-④的实验装置设计一个实验, 以验证上述反应后的混合气中含有二氧化碳、二氧化硫和水蒸气。
实验室利用图④来制乙烯时, 常因温度过高而发生副反应。部分乙醇跟浓硫酸反应生成二氧化硫、二氧化碳、水蒸气和炭黑。请用下列编号为①-④的实验装置设计一个实验, 以验证上述反应后的混合气中含有二氧化碳、二氧化硫和水蒸气。
(1)装置③中的固体药品为 ,用以验证的产物是
(2)装置B中的试剂为 (填“A、B、C、D”)
A.溴水 B.酸性高锰酸钾溶液 C.NaOH溶液 D.饱和NaHCO3溶液
(3)装置②盛有 ,可以验证 气体的存在。
(4)用装置的编号表示其连接顺序(按气体产物从左到右的流向)④→ ;
(5)装置A中的现象是 ,验证 ;
(6)装置C中的现象是 说明 。
25.(3分,每空1分)人们对苯及芳香烃的认识有一个不断深化的过程。
(1)已知分子式为 C6H6 的结构有多种,其中的两种为

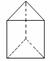 1 mol C6H6 与H2加成时:Ⅰ需______mol,而Ⅱ 需 _______mol。
1 mol C6H6 与H2加成时:Ⅰ需______mol,而Ⅱ 需 _______mol。
(2)今发现 C6H6 还可能有另一种如右图立体结构:该结构的二氯代物有_______种。
24.(6分,每空1分)下图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合(氢原子省略)。回答下列问题:
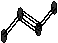
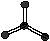
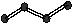

A B C D

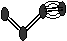

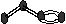
E F G H
(1)图中属于链状烷烃的是 (填编号)
(2)写出上图中B、C的结构简式 B 、C
(3)与A互为同分异构体的是 (填编号)
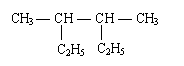 (4)用系统命名法对下列烷烃进行命名:
(4)用系统命名法对下列烷烃进行命名:
①(CH3)2CHC(C2H5)2C(CH3)2C2H5 ②
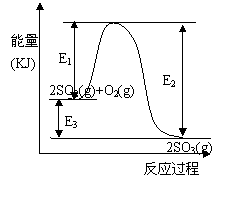
23.(9分)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。T℃时反应2SO2(g)+O2(g) 2SO3(g)过程中的能量变化如图所示,回答下列问题。
2SO3(g)过程中的能量变化如图所示,回答下列问题。

(1)T℃时将3mol SO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。2min时反应达到平衡,此时测得反应物O2还剩余0.1mol
, 则达到平衡时SO2的转化率为 。(1分)
SO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。2min时反应达到平衡,此时测得反应物O2还剩余0.1mol
, 则达到平衡时SO2的转化率为 。(1分)
(2)下列叙述能证明该反应已达化学平衡状态的是 (填序号)(2分)
①SO2的体积分数不再发生变化 ②容器内压强不再发生变化 ③容器内气体分子总数不再发生变化 ④相同时间内消耗2n molSO2的同时生成n molO2 ⑤相同时间内消耗2n molSO2的同时生成2n molSO3
(3) 反应 (填“放出”或“吸收”) 热量(用E1、E2或E3表示)(2分)。
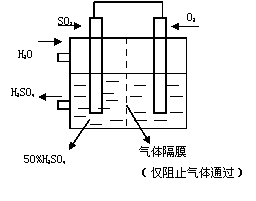 (4)若以右图所示装置,用电化学原理生产硫酸,
(4)若以右图所示装置,用电化学原理生产硫酸,
将SO2、O2以一定压强喷到活性电极上反应。
写出两电极的电极反应式:
;
。(2分) [来网]
为稳定持续生产,硫酸溶液的浓度应维持不变,则通入S O2和水的质量比为 (2分)
O2和水的质量比为 (2分)
22.(7分,每空1分)A、B、C、D为同一周期的四种元素,原子序数依次增大,已知0.2摩A与酸充分反应时,在标况下可生成2.24升氢气;B的氧化物既可溶于强酸又可溶于强碱溶液;C、D阴离子的电子层结构与氩原子相同,C的气态氢化物与C的低价氧化物反应,又可得到C的单质。试回答:
(1)A、B、C、D的元素符号分别为______、____ 、 、______。
(2)用电子式表示A与C形成化合物的过程:
_________________________________________________。
(3)写出B的氧化物与A的氢氧化物反应的离子方程式:
_________________________________ 。
(4)写出实验室制备D的单质的化学反应方程式:
__________________________________________。
21.(3分)按已知的原子结构规律,82号元素X应是第___________周期___________族元素,它的最高正价氧化物的化学式为_____________(该元素的元素符号用X表示)。
20.a mL三种气态烃的混合物和足量的氧气混合点燃爆炸后,恢复到原来的状态(常温常压),气体体积共缩小2a mL(不考虑二氧化碳的溶解)。则三种烃可能的组合是( )
A.CH4、C2H4、C3H4任意体积比
B.CH4、C3H6、C2H2保持C3H6∶C2H2=1∶ 2(物质的量之比)
C.C2H6、C4H6、C2H2同条件下体积比为2∶1∶1
D.C3H8、C4H8、C2H2质量比为11∶14∶26
第Ⅱ卷 (非选择题,共50分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com