
题目列表(包括答案和解析)
4、能发生氧化还原反应的各种离子:Fe3+与S2-、I-、SO32-;ClO-、MnO4-(H+)、NO3-(H+)与S2-、I-、SO32-、Fe2+。
S2-+__Fe3+=__ S↓+__Fe2+;
__I-+__Fe3+=I2+__Fe2+;
__Fe3++SO32-+H2O=__Fe2++SO42-+__H+
__Fe2++__NO3-+__H+=__Fe3++__NO↑+__H2O
__Fe2++__MnO4-+__H+=__Fe3++__Mn2++__H2O
高一化学知识小卡片( 07) _____班 姓名_________
知识点:离子共存(二):
3、(2)若题目限定为酸性,不能大量存在的有:
a、OH- H++OH-=_________;
b、弱酸根:CO32-、HCO3-、SiO32-、S2-、HS-、PO43-、
F-、CH3COO-、HSO3-、SO32-等。
CH3COO-+H+=_________; F-+H+=_________;
S2-+__H+=______↑; HS-+H+=_______↑;
SO32-+__H+=H2O+___↑; HSO3-+H+=H2O+___↑
HCO3-+H+=_______________;
3、分析溶液的酸盐性:
(1)若题目限定为碱性,不能大量存在的有:
a、H+ H++OH-=_________;
b、生成弱碱或不溶碱的阳离子:Fe3+、Al3+、Mg2+、Cu2+、Ag+、NH4+等。
Fe3++__OH-=_________; NH4++OH-=_________;
Al3++__OH-(适量)=___________________;
c、酸式酸根离子:HCO3-、HSO3-、H2PO4-、HS-等。
HCO3-+__OH-=_________; HS-+OH-=_________;
3、分析溶液的酸盐性:
(1)若题目限定为碱性,不能大量存在的有:
a、H+ H++OH-=_________;
b、生成弱碱或不溶碱的阳离子:Fe3+、Al3+、Mg2+、Cu2+、Ag+、NH4+等。
Fe3++__OH-=_________; NH4++OH-=_________;
Al3++__OH-(适量)=___________________;
c、酸式酸根离子:HCO3-、HSO3-、H2PO4-、HS-等。
HCO3-+__OH-=_________; HS-+OH-=_________;
高一化学知识小卡片( 06) _____班 姓名_________
知识点:离子共存(一):
判断溶液中离子是否大量共存可以从以下几方面加以具体分析:1、分析溶液的颜色:
若题目限定是无色透明,则溶液中一定无Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO4-(紫色)等离子。
2、生成沉淀:
SO42-+Ba2+=_________; Ag++Cl-=_________;
Ca2++CO32-=_________;
27.(7分)密闭容器中将3.62 gNaOH、Na2S、Na2SO3的混合物溶于50 mL某浓度的稀 H2SO4
中,不放出任何气体,再加入100 mL 0.1mol·L-1的Ba(OH)2溶液,正好中和过量的
H2SO4。将反应所得沉淀分离、洗净、烘干、称重,其质量为3.29 g 。求:
(1)原混合物中各物质的物质的量之比;
(2)原稀H2SO4的物质的量浓度。
2003-2004学年度下学期
高中学生学科素质训练
26.(5分)20℃时,向足量的硫酸铜饱和溶液中投入1.6g 无水硫酸铜,然后蒸去10 g水,再恢复到20℃。问最终可析出硫酸铜晶体(CuSO4·5H2O)多少克?(20℃时硫酸铜的溶解度是20g)
25.(6分)长期以来一直认为氟的含氧酸不存在。自1997年美国科学家用F2通过细冰末获
得次氟酸(HFO)以来,对次氟酸的研究引起了充分的重视。
(1)次氟酸的电子式是____________,其中氧元素的化合价为_________
(2)写出制取次氟酸的化学方程式:________________________________________
(3)次氟酸很不稳定,试预测其受热分解的可能途径,用化学方程式表示:
_____________________________________________________________________。
(4)次氟酸能与水反应得到溶液A。A中含有B、C两种溶质;B常用于雕刻玻璃;C
在MnO2催化作用下能迅速分解生成一种使带火星的木条复燃的气体。次氟酸与水
反应的化学方程式是 。
(5)将A溶液滴入紫红色酸性高锰酸钾溶液中,溶液的紫红色逐渐褪去。完成并配平下
列有关反应的离子方程式:
 MnO4-+
+
H+
Mn2+ +
+ O2↑
MnO4-+
+
H+
Mn2+ +
+ O2↑
24.(9分)许多元素都存在同位素,同位素在日常生活、工农业生产和科学研究等方面具有很重要的用途,如临床治癌、研究反应机理、核动力发电等。
①国际上一致以碳元素的一种核素-- 原子质量的1/12作为标准来衡量各种原子的相对原子质量。
②据报道,上海某医院正在研究用放射性同位素 治疗肿瘤。该同位素原子核内的中子数是
,该原子的质量是上述碳原子质量的
倍。
治疗肿瘤。该同位素原子核内的中子数是
,该原子的质量是上述碳原子质量的
倍。
③硼元素只有两种天然同位素 和
和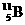 ,硼元素的近似相对原子质量为10.8,则天然硼元素中
,硼元素的近似相对原子质量为10.8,则天然硼元素中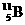 的质量分数为
.
的质量分数为
.
④有机化学中常用18O原子作示踪原子来研究乙酸( )与乙醇(
)与乙醇( )反应生成酯(
)反应生成酯( )和水的反应机理,反应过程中酸分子断裂C-O单键,醇分子断裂O-H键。试完成下列反应方程式:
)和水的反应机理,反应过程中酸分子断裂C-O单键,醇分子断裂O-H键。试完成下列反应方程式:
 .
.
⑤已知反应: KClO3 + 6HCl = KCl + 3Cl2 + 3H2O ,若用K35ClO3与H37Cl作用,则所得氯气的相对分子质量为 .
23.(7分)超重元素的假设预言自然界中可能存在114号的稳定同位素X,请根据原子结构
理论和元素周期律预测:
(1)X元素位于周期表中第_______周期,________族,为_______元素(金属或非金属)
(2)写出其最高价氧化物及其水化物的化学式_______________、_____________,并估
计后者为_____________(酸性或碱性)
(3)它与氯气反应生成的化合物的化学式为_________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com