
题目列表(包括答案和解析)
1] (1)Ⅰ、Ⅱ、Ⅳ、Ⅴ (2)H2O2 SO2 H2S (3)H2O2+SO2=H2SO4 (4)H2O2+H2S=S↓+2H2O
1] (1)SO2 (2)B、C、F B、D、F
1] (1)x≤2/3 d1<d2 (2)x≥2 (3)2/3<x<2
1] (1)B为FeSO4 C为H2S (2)SO2+2Fe3++2H2O=2Fe2++SO42-+4H+
25. 接触法制硫酸排放的尾气中,含少量的二氧化硫。为防止污染大气,在排放前设法进行综合利用。
(1)某硫酸厂每天排放的10000m3尾气中含有0.2%(体积百分数)的二氧化硫,问用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到 kg石膏(CaSO4·2H2O)。
(2)如果将一定体积的尾气通入100mL 2mol/L的氢氧化钠溶液使其完全反应,经测定所得溶液含有16.7g溶质。试分析该溶液的成分,并计算确定各成分的物质的量。
24. 将8.8g FeS固体置于200 mL 2.0 mol/L的盐酸中,以制备H2S气体。反应完全后,若溶液中H2S的浓度为0.10 mol/L,假定溶液体积不变,试计算:
(1)收集到H2S气体的体积(STP);
(2)溶液中Fe2+和H+的物质的量浓度。
23. 某硫酸厂用接触法制硫酸的生产过程中,在锻烧黄铁矿时损失硫为5%(质量分数);在SO2的催化氧化时有92%的二氧化硫转化为三氧化硫;在吸收塔中损失SO3为0.6%(质量分数)。现有含FeS2 95%的黄铁矿(杂质不含硫元素)100t,问可制得98%的浓硫酸多少吨?
22. 已知氢氧化钙在水中存在下列溶解平衡:Ca(OH)2(固体)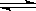 Ca2++2OH-。在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2等,为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏。
Ca2++2OH-。在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2等,为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏。
(1)写出上述反应的两个化学方程式:
①在空气中的SO2与碳酸钙悬浊液反应 ,
②在空气中的SO2与熟石灰悬浊液反应 。
(2)试说明通常用熟石灰悬浊液,而不用澄清石灰水洗涤废气的理由:
(3)在英国进行的一个研究表明:高烟囱可以有效地降低地面SO2浓度。在20世纪60-70年代的10年间,由发电厂排放出的SO2增加了35%,但由于建高烟囱使地面SO2浓度降低了30%之多。请你从全球环境保护的角度,分析这种方法是否可取?
21. 某工厂排出的废水中含有氯气,为了除去废水中的游离氯,且使废水变为中性,有人提出如图所示的方案:在废水排出管的A B处分别注入一定量的废烧碱溶液和亚硫酸钠溶液,已知氯气和亚硫酸钠溶液的反应如下:Cl2+Na2SO3+H2O=Na2SO4+2HCl
某工厂排出的废水中含有氯气,为了除去废水中的游离氯,且使废水变为中性,有人提出如图所示的方案:在废水排出管的A B处分别注入一定量的废烧碱溶液和亚硫酸钠溶液,已知氯气和亚硫酸钠溶液的反应如下:Cl2+Na2SO3+H2O=Na2SO4+2HCl
(1)A、B处应加入的物质的化学式依次为 和 ;
(2)A、B处发生的反应的离子方程式是:A ;B ;
20. 常温常压下,50毫升H2S与60毫升O2混和点燃充分反应后恢复到原状态,可生成SO2多少毫升?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com