
题目列表(包括答案和解析)
25. 充分燃烧某液态芳香烃X,并收集产生的全部水蒸气,恢复到室温时,测得水的质量跟原芳香烃的质量相等。则芳香烃X的分子式是( )
A.C10H14 B.C10H16 C.C12H18 D.C12H20
24. NCl3是一种淡黄色的油状液体,分子为三角锥型结构。下列说法正确的是( )
A. NCl3是非极性分子 B.NCl3具有比P Cl3更强的挥发性
C. NCl3能以配位键和Cl-结合 D. NBr3对光很敏感,NCl3不具有光敏性
23. 分子式为Pt(NH3)2Cl2的化合物分子构型是平面正方形。它有两
种同分异构体--俗称顺铂(I)和反铂(II),其结构式为:
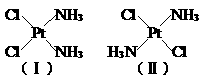
有关顺铂和反铂的水溶液叙述正确的是( )
A. 顺铂水溶性较好 B.反铂水溶性较好
C. 顺铂、反铂水溶性一样 D.它们的水溶性无法比较
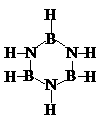
22. 已知化合物硼氮苯(B3N3H6)的分子结构式如右图所示。则硼氮苯
的二氯取代物(B3N3H4Cl2)的同分异构体的数目为( )
A.2 B.3 C.4 D.6
⒈意大利化学家阿伏伽德罗(A.Avogadro)在化学上的重大贡献是( )
A. 提出了科学的原子学说 B. 测出了阿伏伽德罗常数的近似值
C. 创立了分子学说 D. 制定了物质的量的单位--摩尔
⒉1molO2的物质的量是1个O2分子量的( )
A. 2×6.02×1023倍 B. 2/3 ×6.02×1023倍
C. 3/2 ×6.02×1023倍 D. 3×6.02×1023倍
⒊不久前,我国科学家首次合成了一种新核素,其符号是18572Hf. 关于18572Hf.的下列说法中正确的是( )
A. 是人类发现的一种新元素 B. 是一种新的原子
C. 其原子核内有113个质子 D. 其原子质量约是12C原子质量的185倍
⒋我国兰州的近代物理研究所曾经研究制出首批重氧气(18O2),其价格远远超过黄金。用NA表示阿付伽德罗常数,下列叙述中正确的是( )
A.22.4L重氧气所含的分子数为NA
B. 1.8g重氧气的物质的量为0.1mol
C.2.0的重(氧)水(1H218O)所含的中子数为NA
D.18g重氧气所含的原子数为2NA
⒌下列离子中最外层电子数为8的是( )
A.Fe3+ B.Li+ C.Ti4+ D.Fe2+
⒍在体积为V L的干燥烧瓶中用排空气法冲入氯化氢气体后,测得烧瓶中气体对氧气的相对密度为1.082。若用此气体进行喷泉实验,在喷泉停止后,进入烧瓶中的液体的体积是( )
A.V L B. 3/4 V L C. 1/2 V L D.1/4 V L
⒎电导仪测得液态BrF3具有微弱的导电性,表示BrF3(液态)中的阴、阳离子Xn-和Yn+存在。Xn-和Yn+也存在于BrF2SbF6、KBrF4、(BrF2)SnF6等化合物中。则Xn-、Yn+的化学式分别为( )
A. Xn- = F- , Yn+ = Br3+ B. Xn- = BrF4- , Yn+ = BrF2+
C. Xn- = F- , Yn+ = BrF2+ D. Xn- = BrF4- , Yn+ = Br3+
⒏一氧化碳和氢气的混合气体共10cm3,完全燃烧时用去5cm3氧气。此混合气体中一氧化碳和氢气的体积比最合理的答案是( )
A.1 : 1 B.2 : 1 C. 3 : 1 D.任意比
⒐下列关于核电荷数1-18的元素的叙述中正确的是( )
A. 最外层只有1个电子的原子一定属于碱金属元素
B. 主族元素的最高正价与其最外层电子数不一定相等
C. 只有卤族元素才能获得1个电子形成稳定的结构
D. 原子核最外层电子数和族序数相等
⒑在100ml含等物质的量的HBr和H2SO3的溶液中通入0.01molCl2,有一半Br-变成Br2.已知SO2能使溴水退色。则原溶液中HBr和H2SO3的浓度都等于( )
A.0.0075mol/L B.0.0080 mol/L C.0.075 mol/L D.0.080 mol/L
⒒人类岁发现新元素的研究始终没有停止过。1999年科学家合成114号元素后,仅仅四个月的时间又传来合成116号118号元素的报告。已知铷(Rb)的原子序数为37。则118号元素位于元素周期表的在( )
A.第五周期 VII A族 B.第六周期 VII A族
C.第七周期 零族 D.第八周期 I A族
⒓取10ml(1:3)的硫酸溶液,加入2g某元素(M)的高价氧化物,再逐渐滴加入5ml 20%NaSiO3溶液,可得到一种黄色胶状物;将它涂敷在白色的滤纸上阴干,即为“酒精测试纸”。此试纸遇“酒气”会由黄色变蓝色。已知M元素的相对原子质量为50,中子数为26,则M元素的符号为( )
A. U B.Cr C.Mn D.Fe
 ⒔世界卫生组织(WHO)将二氧化碳(ClO2)列为A级高效、安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着广泛的应用。下列说法正确的是( )
⒔世界卫生组织(WHO)将二氧化碳(ClO2)列为A级高效、安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着广泛的应用。下列说法正确的是( )
A. ClO2是强氧化剂 B. ClO2是强还原剂
C. ClO2是离子化合物 D. ClO2中氯元素为-1价
⒕有人设计右图装置吸收氯化氢气体或氨气能取得良好的效果。
由图可 推测(X)可能是( )
A. 苯 B. 甘油 C. 四氯化碳 D. 苯胺
⒖将等体积的氢硫酸与亚硫酸钠溶液混合,并加入适量硫酸,即有黄色 沉淀产生;微热,无酸性气体产生,这表明原混合溶液中H2S和Na2SO3的物质的量之比是( )
A.1:2 B.2:1 C.3:2 D.1:1
⒗超氧化钾(KO2)常用于急救中,发生与Na2O2类似的化学反应。若有156g金属钾在一定条件下完全转化成KO2,用此KO2,吸收足量的CO2时可生成标准状况下的O2是( )
A.22.4L B.11.2L C.44.8L D .67.2
⒘工业上常用侯德榜先生发明的联合制碱法生产碳酸钠(纯碱)和氯化铵,但却不能用此法制取碳酸钾,这是因为在溶液中( )
A. K2CO3融解度较小 B. K2CO3融解度较大
C. KHCO3融解度较小 D. KHCO3融解度较大
⒙分子间存在着范德华力(分子作用间力)的实验事实是( )
A. 食盐、氯化钾等晶体易溶于水 B. 氯气在加压、降温时会变成液氯或固氯
C. 融化的铁水降温可铸成铁锭 D. 金刚石有相当大的硬度
 ⒚六氟化硫(SF6)通常是一种无色气体,具有很强的稳定性,可用于灭火。SF6的分子结构如右图所示,呈八面体型。如果F元素有两种稳定的同位素,则SF6的不同分子数为( )
⒚六氟化硫(SF6)通常是一种无色气体,具有很强的稳定性,可用于灭火。SF6的分子结构如右图所示,呈八面体型。如果F元素有两种稳定的同位素,则SF6的不同分子数为( )
A. 6种 B. 8种 C. 10种 D. 12种
⒛按规定在食盐中添加一定量的碘化钾(KIO3)即成为可以 为人体补充碘元素的“加碘食盐”。KIO3可用在一定温度下电解KI水溶液的方法制得:
KI+3H2O KIO3+H2↑
KIO3+H2↑
以下关于这一生产得叙述正确的是( )
A. 石磨棒作正极,不锈钢棒作负极
B. 不锈钢棒作阳极,石磨棒作阴极
C. 产生IO3-离子的电极周围溶液pH增大
D. 产生H2电极周围溶液pH增大
21.不久前,欧盟对我国出口酱油进行检测时发现部分酱油中的可能致癌物--3-氯-1,2-丙二醇(CH2OH-CHOH-CH2Cl)严重超出正常标准。为此应对这部分酱油进行化学技术处理。处理过程中应用的化学反应是( )
 A.中和反应 B. 氧化反应 C.消去反应 D.取代反应
A.中和反应 B. 氧化反应 C.消去反应 D.取代反应

⒈反应(Ⅰ)属_________反应,反应(Ⅱ)属__________反应。(每空1分)
⒉现取CH3CH2Br,依上述条件及过程可合成相应的稳定的一元羧酸A和B,请写出其结构简式。(每空2分)
A:_________________________, B:_______________________________
⒊如需合成稳定的一元羧酸△-COOH,所需溴代烃的结构简式为_______________,用此溴代烃还能合成稳定的二元羧酸A’和B’,其结构式为:(每空2分)
A’:_________________________, B’:______________________________。



R-X RMgX
现有乙烯和必要的无机原料合成3-甲基-3-戊醇,合成路线如下:
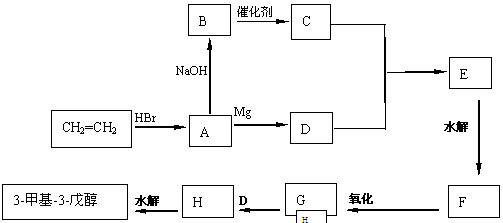
请写出A、B、C、D、E、F、G、H物质的结构简式:(每空2分)
A:___________________B:_____________________C:_________________________
D:___________________E:_____________________ F:_________________________
G:_________________________________ H:_________________________________
⒈按上述微粒数的计算规则,则一个NaCl晶胞中有____个Na+,____个Cl-。(每空1 分)
⒉KCl和NaCl的晶格型式相同。已知Na+离子的半径是Cl-离子的0.5倍,而又是K+离子的0.7倍,计算:KCl晶胞和NaCl晶胞的边长之比;KCl和NaCl晶体的密度之比。(相对原子质量:K:39,Na:23,Cl:35.5)(4分)
解:
⒊将NaCl晶胞中的所有Cl-去掉,并将Na+全部换成C原子,再在每两个不共面的“小立方体”中心处各放置一个C原子便构成了金刚石的一个晶胞,则一个金刚石的晶胞中有________个C原子。(1分)
⒋计算金刚石的密度。(已知C原子的半径为7.7×10-11m,相对原子质量:12(4分)
⒌白硅石SiO2属AB2型共价键晶体。若将金刚石晶胞中的所有C原子换成Si原子,同时在每两个相邻的Si原子(距离最近的两个Si原子)中心联线的中点处增添一个O原子,则构成SiO2晶胞,故SiO2晶胞中有_______个Si原子,______个O原子,离O原子最近的Si原子有_______个,离Si原子最近的O原子有_______个。(每空1分)
⒍干冰(固态CO2)属于分子晶体。若把每个CO2分子抽象为一个质点(微粒),则其晶胞也属于立方面心晶格,故一个干冰晶胞中有_________个CO2,在干冰分子中,原子之间靠_________________结合,CO2分子之间靠______________结合。(每空1分)
今欲测定某样品四氧化三铅含量,称取Pb3O40.1000g,加酸溶解,得到含Pb2+的溶液,加热下用过量K2Cr2O7将Pb2+沉淀为PbCrO4,反应为
2Pb2++Cr2O72-+H2O=2PbCrO4↓+2H+,
冷却后过滤洗涤,将PbCrO4沉淀用HCl溶液溶解,加入过量KI,用0.1000mol·L-1Na2S2O3溶液滴定,终点时用去12.00mL。
⒈写出PbCrO4沉淀溶解和滴定过程的化学方程式;(3分)
解:
⒉计算试样中Pb3O4的质量分数;(Pb3O4的相对分子质量为685.6)(4分)
解:
⒊用标准溶液滴定时应用指示剂?(1分)____________
⒋加入过量KI后,反应需在暗处放置5-10分钟,为了防止生成的I2挥发,可选用何种仪器?(2分)___________
⒈电解时发生的电极反应为:(各2分)
阳极反应:_____________________________________________________
阴极反应:_____________________________________________________
⒉写出Cr2O72-转变为Cr3+的离子方程式:(2分)
⒊与Cr(OH)3沉淀同时生成的沉淀还有_____________________。(2分)
⒋电解过程中这些沉淀是怎样产生的?(4分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com