
题目列表(包括答案和解析)
25、将质量为m1的NaHCO3固体加热分解一段时间后,测得剩余固体的质量为m2 。
(1)生成的Na2CO3的质量为 。
(2)当剩余固体的质量为 时,可以判定NaHCO3已完全分解。
24、现有下列3个氧化还原反应:
2 FeCl3 + 2 KI = 2 FeCl2 + 2 KCl + I2 2 FeCl2 + Cl2 = 2 FeCl3
2 KMnO4 + 16 HCl = 2 KCl + 2 MnCl2 + 5 Cl2↑ + 8 H2O
(1)若某溶液中有Fe2+、I - 和Cl - 共存,要除去I - 而不影响其他离子的存在,可加入上述反应物中的试剂是 。
(2)在强酸性溶液中,将MnO4-、Fe2+、Fe3+、I - 四种离子的溶液混在一起,充分反应后:
① 若溶液中有I - 剩余,则溶液中一定无 。
② 若溶液中有MnO4- 剩余,则溶液中一定无 。
23、已知铜在常温下能被稀HNO3溶解:3Cu + 8 HNO3 = 3Cu(NO3)2 + 2NO↑+ 4H2O
(1)请将上述反应改写成离子方程式(并标明电子转移方向和数目):
(2)上述反应中,HNO3没有全部参加氧化还原反应,没有参加氧化还原反应的硝酸与总硝酸的物质的量之比是 。
21、3 mol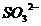 离子恰好将2mol
离子恰好将2mol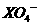 离子还原,则X元素在还原产物中的化合价为
。
离子还原,则X元素在还原产物中的化合价为
。
22、在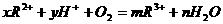 中,
中, 为 。
为 。
20、在反应8NH3 + 3Cl2== 6NH4Cl + N2中, 若有2molNH3被氧化,则( )
A、生成1molN2 B、有4molNH3 参加反应
C、3 mol氯原子被还原 D、3molCl2被氧化
19、将4.6g Na 投入足量的水中得到200mL 溶液,该溶液的物质的量浓度是( )
A、0.1 mol/L B、0.2 mol/L C、1 mol/L D、2 mol/L
18、溴化碘(IBr)的化学性质类似卤素单质,它同水反应的化学方程式为
IBr + H2O = HBr + HIO
下列有关IBr的叙述不正确的是( )
A、IBr是共价合物 B、在化学反应中,IBr可做氧化剂
C、IBr跟水反应时既不是氧化剂也不是还原剂
D、IBr跟NaOH稀溶液反应生成NaI、NaBrO和水
17、向溴化钠、碘化钠的混合溶液中通入足量氯气之后加热,将溶液蒸干,并灼烧片刻,最后残留的物质是( )
A.NaCl B.NaCl、NaBr、NaI C.NaBr、NaI D.NaCl、I2
16、将碘和食盐分离开的最好的方法是( )
A.升华 B.筛选 C.结晶 D.过滤
15、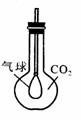 已知氧化物有普通氧化物,如Na2O;过氧化物,如Na2O2;超氧化物,如KO2;臭氧化物,如RbO3,其中后三种均能与水或CO2反应产生O2。如右图所示,现已用平底烧瓶收集得到CO2 ,在瓶内有一只扎紧在玻璃管末端的气球,打开塞子迅速往瓶里加入下列某物质,并立即塞紧塞子,一段时间后,气球就会自动膨胀起来。则该物质是
已知氧化物有普通氧化物,如Na2O;过氧化物,如Na2O2;超氧化物,如KO2;臭氧化物,如RbO3,其中后三种均能与水或CO2反应产生O2。如右图所示,现已用平底烧瓶收集得到CO2 ,在瓶内有一只扎紧在玻璃管末端的气球,打开塞子迅速往瓶里加入下列某物质,并立即塞紧塞子,一段时间后,气球就会自动膨胀起来。则该物质是
A. Na2CO3 B. Na2O2 C. KO2 D. RbO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com