
题目列表(包括答案和解析)
3.下列反应既是离子反应又是氧化还原反应的是( )
A.BaCl2溶液中滴入稀H2SO4
B.盐酸和氧化镁
C.铁片放入CuSO4溶液中
D.氢气还原氧化铜
2.下列四种物质的溶液中,所含微粒种类最多的是( )
A.盐酸 B.硫酸
C.氢氧化钡 D.醋酸
1.在氧化还原反应中,下列说法正确的是( )
A.失去电子被氧化,发生了氧化反应,该物质是氧化剂
B.氧化剂被氧化,还原剂被还原
C.氧化剂得到电子被还原,其产物为氧化产物
D.得到电子的物质被还原,元素化合价降低,表现氧化性
24.(6分)在标准状况下,将224 L 气体溶于635 mL(
气体溶于635 mL(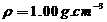 )的水中,所得盐酸的密度为1.20
)的水中,所得盐酸的密度为1.20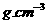 ,试求:(1)该盐酸的物质的量浓度
,试求:(1)该盐酸的物质的量浓度
(2)标准状况下,取这种盐酸100 mL与足量的 溶液反应后,放出多少升气体?气体干燥后,通过盛有足量
溶液反应后,放出多少升气体?气体干燥后,通过盛有足量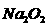 固体的容器,充分反应后,容器内固体增重多少克?
固体的容器,充分反应后,容器内固体增重多少克?
解:
重庆市垫江师范2005-2006学年度上学期期中考试
23、(4分)49 g硫酸的物质的量为________mol,若在水中完全电离可产生________mol 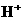 ,________mol
,________mol 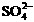 .若有一定量的硫酸完全电离产生
.若有一定量的硫酸完全电离产生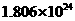 个
个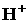 ,此硫酸的质量为________g.
,此硫酸的质量为________g.
22、Ⅰ、(8分)用浓H2SO4(质量分数为98%、密度为1.8g/cm3)配制500mL3.6mol/L的稀H2SO4,回答下列问题:
(1)该实验中所用的实验仪器除了烧杯、量筒、玻璃棒以外,还需要的仪器有_______________。
(2)该实验中的部分操作如下:
A、用量筒量取一定量浓H2SO4
B、将所取的浓H2SO4注入烧杯中,并加入适量水溶解
C、将溶解后的硫酸沿玻璃棒立即转入500mL容量瓶中
D、洗涤烧杯2-3次,并把洗涤液沿玻璃棒注入容量瓶中
所取浓H2SO4的体积为______________________mL;
上述操作有明显错误的有(填字母编号)___________________________。
(3)下列操作会使所配H2SO4溶液浓度偏低的有___________。
A、所用容量瓶底部有少量蒸馏水 B、定容时俯视刻度线
C、定容时仰视刻度线 D、洗涤烧杯的溶液没有转入容量瓶中
II(6分)在干燥管A中的块状白色固体为某种正盐,B中为淡黄色粉末,C中为白色粉末,并将A、B、C按图2-3所示连接。打开活塞(1)(3)时,D中蜡烛火焰熄灭,C中白色粉末变蓝;当打开活塞(1)(2)时,D中蜡烛火焰变得更明亮;关闭活塞(1)时,A中反应可自行停止。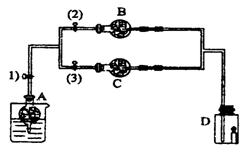
(1)装置B的淡黄色粉末是:_____,干燥管 C中的白色固体应为_____;
(2)A中发生的化学反应方程式___________________________
(3)B中发生的化学反应方程式___________________________
19 A.(3分)现有以下物质:①氮气 ②液态CO2 ③氯化氢气体 ④铜片 ⑤硫酸钡晶体 ⑥蔗糖 ⑦酒精 ⑧熔化的KNO3 ⑨NaOH溶液, 请回答下列问题(填序号):
(1)以上物质能导电的是 ,。
(2)以上物质中属于电解质的是 ,
(3)以上物质属于非电解质的是 。
B、(3分) 在进行有关燃料充分燃烧的条件讨论时,有两种意见:甲同学认为:空气越多越好,乙同学认识:空气足量即可.你认为上述哪一位同学的意见是不正确的?理由是什么?答__________ , ______________________________________
C、(4分)用双线桥表示下列反应中得失电子的情况,并指明氧化剂、还原剂、氧化产物、还原产物:
3FeO + 10HNO3 == 3Fe(NO3)3 + NO↑ + 5H2O.
20. A(1分)写出符合离子方程式Ba2++SO42- =BaSO4↓的一个化学方程式是
。
A(1分)写出符合离子方程式Ba2++SO42- =BaSO4↓的一个化学方程式是
。
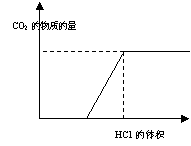
B.(3分)下图表示的是往某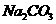 溶液中
溶液中
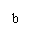 滴入稀盐酸产生CO2的过程。
滴入稀盐酸产生CO2的过程。
(1)写出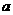 点以前发生反应的离子方程式
。
点以前发生反应的离子方程式
。
(2)写出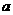 点到
点到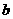 点发生反应的离子方程式
。
点发生反应的离子方程式
。
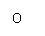
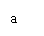 (3)若某
(3)若某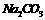 溶液中含
溶液中含

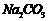 ,向其中滴入一定量的稀盐酸,恰好使溶液中
,向其中滴入一定量的稀盐酸,恰好使溶液中 和
和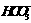 的物质的量之比为2:1,则滴入稀盐酸的物质的量等于
的物质的量之比为2:1,则滴入稀盐酸的物质的量等于
 (用
(用 表示)。
表示)。
21(8分)碱金属元素的原子最外电子层均有________个电子,在化学反应中容易________电子,形成________离子.它们的单质都有________性.随着核电荷数增加,碱金属原子的电子层数依次________,原子半径依次________,原子核对外层电子的引力逐渐________,所以它们的金属性________. 若以R代表碱金属元素,则其氢氧化物的通式为___________________,在水溶液中显碱性。含有两个电子层的碱金属是____,通常保存在_________中;由于钠___________________________________,因此钠通常保存在____________中。
18、如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(式中NA为阿伏加德罗常数)
A.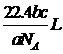 B.
B.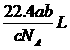 C.
C.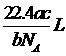 D.
D.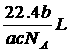
 重庆市垫江师范2005-06学年度高一上学期化学期中考试
重庆市垫江师范2005-06学年度高一上学期化学期中考试
高一年级化学试卷成绩统计表(考生不要填写)
|
题 号 |
一 |
二 |
三 |
四 |
总
分 |
|||
|
19 |
20 |
21 |
22 |
23 |
||||
|
得 分 |
|
|
|
|
|
|
|
|
第I卷答题栏(选择题,共54分)
17、下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应的本质(生成的产物)并不改变的是
A.Na和O2 B.NaOH和CO2
C.Na2O2和CO2 D.木炭(C)和O2
14.下列说法正确的是
A化石燃料在任何条件下都能充分燃烧 B. 氧化还原反应中一定有元素化合价发生变化
C.有氧元素参加的反应一定是氧化还原反应 D. 阴离子都是还原剂
15下列反应既属于氧化还原反应,又是吸热反应的是
A. 铝片与稀硫酸的反应 B. Ba(OH)2·8H2O与NH4Cl的反应
C. 灼热的碳与CO2的反应 D. 甲烷在氧气中燃烧
16已知在某温度下发生如下三个反应:
①
C+CO2 2CO ② C+H2O
2CO ② C+H2O CO+H2
③ CO+H2O
CO+H2
③ CO+H2O CO2+H2
CO2+H2
由此可以判断,在该温度下C、CO、H2的还原性强弱顺序是
A.CO>C>H2 B.C>CO>H2
C.C>H2>CO D.CO>H2>C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com