
题目列表(包括答案和解析)
25.某氯化钠晶体是由Na+、35Cl-和37Cl-组成,在熔融状态下电解,生成的氯气对甲烷的相对密度为4.525(同温同压)求这种NaCl晶体中37Cl-的离子数约占阴离子总数的百分数。
江苏省新海高级中学2005-2006学年度第二学期阶段考试
24.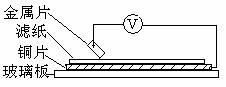 (5分)将洁净的金属片A、B、C、D分别放置在浸有NaCl溶液的滤纸上面并压紧(如图)。在每次实验时,记录电压表指针的偏转方向和电压的读数如下:
(5分)将洁净的金属片A、B、C、D分别放置在浸有NaCl溶液的滤纸上面并压紧(如图)。在每次实验时,记录电压表指针的偏转方向和电压的读数如下:
|
金属 |
电子流动方向 |
电压 |
|
A |
A→Cu |
+0.78 |
|
B |
Cu→B |
-0.15 |
|
C |
C→Cu |
+1.35 |
|
D |
D→Cu |
+0.30 |
已知:构成两电极的金属活动性相差越大,电压表的读数越大。请依据表中数据判断:
(1)还原性最强的金属是 ;一定不能从硫酸铜溶液中置换出铜的金属是 。
(2)在滤纸上能看到有蓝色沉淀析出的是 (填字母)金属,其对应的原电池的电极反应为:
负极: 正极: 。
23.(5分)现有原子序数之和为51的五种短周期元素A、B、C、D、E。已知:A、B、E、C、D原子序数依次增大;A的单质在常温下为无色气体;B原子的最外层电子数比次外层电子数多3个;C和B同主族;D的最高价氧化物的水化物的酸性在同主族元素中是最强的,E元素最外层电子数与其K层电子数相同.
(1)试写出它们的元素符号: C______、D______、E______;
(2)写出A与B反应的生成物的电子式是________________,结构式是____ _______。
22.(18分)A、B、C、D、E、F六种短周期元素的原子序数依次增大,已知:
①A原子核内只有1个质子;②B原子最外层电子数是次外层电子数的2倍;③C原子最外层电子数比次外层电子数多4个;④D原子的次外层电子数是最外层电子数的8倍;⑤E单质既能和盐酸反应又能和烧碱反应;⑥F与C同主族。用化学符号或化学用语回答下列问题:
(1)写出F离子的结构示意图 ;
(2)用电子式表示下列物质BC2 ,D2C2_________________;
(3)用电子式表示D与F形成化合物的过程 ;
(4)用“化学式”和“< >”比较A与C、A与F形成化合物的稳定性 ,沸点的高低 ,沸点高低的原因 ;
(5)分别写出E的最高价氧化物对应水化物与D和F的最高价氧化物对应水化物反应的离子方程式:
。
21.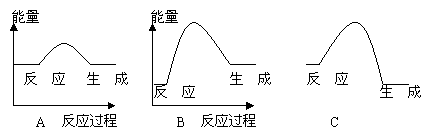
 (3分)下列各图表示正反应是吸热反应的是:
(3分)下列各图表示正反应是吸热反应的是:
20.(5分)下列结论正确的是
①微粒半径:S2->Cl>S>F; ②氢化物稳定性:HF>HCl>H2S>H2Se; ③离子还原性:S2->Cl-> Br->I-; ④氧化性:Cl2>S>Se>Te; ⑤酸性:H2SO4>HClO4>H2SeO4; ⑥非金属性:F>Cl>S>Se ⑦碱性:NaOH>Mg(OH)2>Al(OH)3 ⑧原子半径:Na<Mg<Al ⑨离子氧化性:Na+<Mg2+<Al3+ ⑩单质的还原性:Al>Mg>Na
19.(1)(5分)用A.质子数B.中子数C.核外电子数D.最外层电子数 E.电子层数,填写下列空格。
①核素种类由________决定;②元素种类由________决定;③元素的化学性质主要由________决定;④元素的周期数由 决定;⑤离子所带电荷数由 决定。
(2)(5分)构成下列化合物的化学键是(用离子键、极性键、非极性键):
①NaCl ,②Na2O2 ,③NH4Cl 。
18.a、b、c、d四种主族元素,a、b元素的简单阳离子和c、d元素的简单阴离子都具有相同的电子层结构,且a的阳离子氧化性小于b的阳离子的氧化性,c的阴离子所带的负电荷数小于d的阴离子所带负电荷数。则下列说法正确的是:
A.原子序数:b>a>d>c B.原子半径:b>a>d>c
C.c的气态氢化物的稳定性大于d的气态氢化物的稳定性
D.a的最高价氧化物的水化物的碱性大于b的最高价氧化物的水化物的碱性
 请将第Ⅰ卷答案填写在下列表格中
请将第Ⅰ卷答案填写在下列表格中
第Ⅱ卷(非选择题,共52分)
17.X、Y、Z和R分别代表四种元素,如果aXm+、bYn+、cZn-、dRm-四种离子的电子层结构相同,则下列关系正确的是
A.a-c = m-n B.a-b = n-m C.c-d = m+n D.b-d = n+m
16.下列说法中,正确的是
A.双原子分子中的共价键,一定是非极性键 B.非极性键也可能存在于离子化合物中
C.HCl分子中只有一对共用电子对,H2S分子中有两对共用电子对,故H-Cl键的极性比H-S键的极性弱
D.I2单质的升华、NaCl晶体熔化、HCl气体溶于水时,均不需要破坏化学键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com