
题目列表(包括答案和解析)
20. (9分)1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如下图所示,呈V型,键角116.5℃。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子。请回答:
(9分)1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如下图所示,呈V型,键角116.5℃。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子。请回答:
⑴臭氧与氧气的关系是: 同素异形体 。(2分)
⑵写出下列分子与O3分子的结构最相似的是: C 。(2分)
A.H2O B.CO2 C.SO2 D.BeCl2
⑶分子中某原子有1对没有跟其他原子共用的价电子叫孤对
电子,那么O3分子有 5 对孤对电子。 (1分) ⑷
⑷O3分子是否为极性分子 (填“是”或“否”)。
⑸O3与O2间的转化是否为氧化还原反应 否 (若否,请回答A小题;若是,请回答B小题)A.O3具有强氧化性,它能氧化PbS为PbSO4而O2不能,试配平:
19. (12分) 短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素。试回答下列问题:
⑴A的元素符号为: O ;D的原子结构示意图是:Cl的原子结构示意图;
⑵A、B、C三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示) S2- > O2- >。。
⑶A、B、C、D形成的化合物B2A2、CD2、D2A、DA2中各原子都满足最外层8电子结构的是 NaO SCl ClO (填写具体的化学式 )。(
⑷CA2与D元素的单质在水溶液中反应的化学方程式是:SO+ClO = 2HCl +HSO2分)。
18. 两份质量均为1克的硫粉,分别使之与足量的H2和O2完全反应,将产生的含硫化合物混合,最终可得硫粉
A. 2g B. 1.5g C. 1g D. 0.5g
-2-
第Ⅱ卷 非选择题 (56分)
17.下列离子方程式书写正确的是
A.二氧化硫与水反应:SO2 + H2O === 2H++SO32-
B.碳酸钙与盐酸反应:CO32-+2H+ === CO2↑+ H2O
C.铁与稀硫酸反应:Fe+2H+ === Fe2++H2 ↑
D.硫酸铜溶液与氢氧化钡溶液反应:Ba2+ + SO42-== BaSO4↓
16. 检验二氧化硫气体中有无二氧化碳气体,应采取的方法是
A.通过澄清石灰水 B.先通过足量小苏打溶液,再通过石灰水
C.通过品红溶液 D.先通过足量酸性高锰酸钾溶液,再通过澄清石灰水
15. 对以下事实解释错误的是
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.氢气可以在氯气中燃烧,说明燃烧反应未必需要氧气参与
C.常温下,浓硫酸可以用铝罐贮存,说明铝与浓硫酸根本就不会反应
D.反应CuSO4+H2S==CuS↓+H2SO4能进行,说明CuS既不溶于水,也不溶于稀硫酸
14.用mgCu与足量的浓硫酸共热,当反应完毕后,生成VL的二氧化硫,则被还原的硫酸
A.m/64 mol B.V/11.2 mol C.V/22.4 mol D.49V/5.6 mol
13. 有关过氧化氢(H2O2)的下列叙述不正确的是
A. H2O2的沸点比水高,但受热容易分解
B. H2O2中的氧元素为-1价,它的水溶液俗称双氧水,呈弱酸性
|
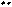 D. H2O2的电子式是:H+[:O:O:]2-H+
D. H2O2的电子式是:H+[:O:O:]2-H+
12.下列各组中的离子,能在溶液中大量共存的是
A. Na+、Cu2+、Cl-、SO42- B. Na+、Ca2+、CO32-、NO3-
C. Na+、H+、Cl-、HCO3- D. K+、Fe3+、SO42-、OH-
11. 下列元素的最高价氧化物溶于水一定能生成强碱的是
A. 原子次外层电子数是最外层电子数8倍的元素
B. 原子次外层电子数是最外层电子数2倍的元素
C. 原子次外层电子数是最外层电子数4倍的元素
D. 最外层电子数为1的元素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com