
题目列表(包括答案和解析)
24.(6分)有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷数总和为38,Y元素原子最外层电子数占核外电子总数的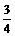 ;W元素原子最外层电子比同周期Z元素多5个电子,W和Y不属于同一主族。
;W元素原子最外层电子比同周期Z元素多5个电子,W和Y不属于同一主族。
(1)写出元素符号:X ,Y ,Z ,W ;
(2)Z、W两种元素最高价氧化物对应水化物反应的方程式是
23. ( 3分) 已知SO2遇H2S气体时表现出氧化性,发生如下反应:SO2+2H2S=3S+2H2O,在标准状况下,向一个容积为1L的容器里加入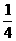 L的SO2和
L的SO2和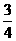 L的H2S,则反应结束时容器中的压强是开始的 倍。(水蒸气压忽略不计)
L的H2S,则反应结束时容器中的压强是开始的 倍。(水蒸气压忽略不计)
22.(6分)下图虚线框中的装置可用来检验浓H2SO4与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白:(已知:高锰酸钾溶液呈紫色,有强氧化性能与二氧化硫反应)
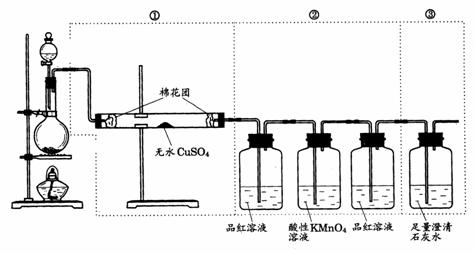
(1)如果将装置中①、②、③三部分仪器的连接顺序变为②、①、③,则可以检出的物质是________;不能检出的物质是_____________.
(2)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是________;不能检出的物质是________.
(3)如果将仪器的连接顺序变为②、③、①,则可以检出的物质是________;不能检出的物质是________.
21.(4分)用化学用语回答下列问题。
⑴写出NaOH的电子式:_ _。
⑵某种硅酸盐的主要成分为Na2CaSi6Ox,其中x= ,
(3)用电子式表示H2S分子的形成过程:
(4)画出S2-的离子结构示意图:_ _。
第Ⅱ卷(非选择题 4 0分)
24.将1.95g由Na2SO4和Na2CO3组成的混合物溶于水得溶液A,在A中加入10mL未知浓度的BaCl2溶液恰好完全反应,过滤得沉淀B,向B中加入足量稀硫酸,沉淀不消失反而增加0.18g。计算:
(1)原混合物中Na2CO3的质量分数。(保留三位小数)
(2)BaCl2溶液的物质的量浓度。
-4-
 武汉市部分重点中学2005-2006学年度下学期期中联考
武汉市部分重点中学2005-2006学年度下学期期中联考
23.(10分)有一种不溶于水的固体A,加热条件下A和H2反应生成气体B;A和O2在点燃条件下反应生成气体C;B与C两种气体相遇又生成固体A和水;将A与钠反应生成的白色固体D,D溶于稀盐酸,又生成气体B;B能使湿润的蓝色石蕊试纸变红,也能使溴水褪色生成固体A。试推断
⑴A,B,C,D的化学式:A___S______;B_HS ___;C_SO____;D__NaS __ 。(4分)
⑵写出下列反应方程式 :
B和C反应:___2HS +SO ==3S+2HO ______ ;(
D溶于稀盐酸: NaS + 2HCl ==2NaCl +HS↑ ;
B使溴水褪色: HS +Br ==2HBr + S↓ 。
22.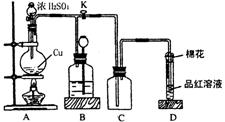 (14分)某化学兴趣小组为探究铜跟浓硫酸的反应,用右图所示装置进行有关实验。请回答:
(14分)某化学兴趣小组为探究铜跟浓硫酸的反应,用右图所示装置进行有关实验。请回答:
⑴装置A中发生的化学反应方程
式为: Cu + 2HSO (浓) CuSO + SO↑+ 2HO 。
⑵装置D中试管口放置的棉花中应浸一种液体,这种液体是碱液(其他合理答案均可给分) ,
其作用是吸收多余的二氧化硫,防止污染空气。
⑶装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是_试剂(或广口)瓶中液面下降,长颈漏斗中液面上升。B中应放置的液体是(填字母)_d 。
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
⑷实验中,取一定质量的铜片和一定体积18 mol · L – 1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。请回答下列问题:
①有一定量的余酸但未能使铜片完全溶解,你认为原因是_反应过程中浓硫酸被消耗,逐渐变稀,而铜不和稀硫酸反应 。
-3-
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是_a、d (填字母)。
a.铁粉 b.BaCl2溶液 c.银粉 d.Na2CO3溶液
21. (5分)检验SO42-应向被测溶液中先加入适量的盐酸,如果无明显变化,再滴入氯化钡(或氢氧化钡)溶液,观察到有白色沉淀生成,可判断原溶液中含有SO42-。如果向被测溶液中先滴加BaCl2溶液,有白色沉淀生成,再滴加稀盐酸,沉淀不消失,则该溶液除可能含SO42-外,还可能含有Ag+。如果向被测溶液中滴加Ba(NO3)2溶液,有白色沉淀生成,再滴加稀硝酸,白色沉淀不消失,则该溶液除可能含有SO42-外,还可能含有SO- 。
1]PbS+[ 4 ]O3===[ 1 ]PbSO4+[ 4 ]O2 (2分)
B.O3在催化剂作用下生成1molO2,转移电子数为_________mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com