
题目列表(包括答案和解析)
5.下列哪个反应可用Ca2++CO32-=CaCO3↓表示 ( CD )
A.向Ca(OH)2溶液中通入CO2 B.CaCl2溶液和BaCO3 混合
C.Ca(NO3)2溶液和Na2CO3溶液混合 D.Ca(OH)2溶液和Na2CO3溶液混合
4.下列电离方程式中,错误的是 ( BC )
A.H2CO3  H++HCO3- HCO3-
H++HCO3- HCO3-  H++CO32-
H++CO32-
B.H2SO4 2H++SO42-
2H++SO42-
C.NaHS=Na++H++S2- D.NaHSO4=Na++H++SO42-
3.关于强电解质的叙述正确的是 ( CD )
A.在固体状态下能导电的物质 B.在水溶液里能导电的化合物
C.强酸、强碱和大多数盐属于强电解质 D.在水溶液里或熔化状态下几乎完全电离的化合物
2.关于电解质的下列说法中正确的是 ( D )
A.在水溶液中和熔化状态下能导电的化合物
B.在水溶液中或熔化状态下能导电的物质
C.在水溶液中或熔化状态下能导电的化合物
D.在水溶液中或熔化状态下导电所需的离子由原物质本身电离出来的化合物
1.氧化还原反应的实质是 ( C )
A.氧元素的得与失 B.化合价的升降
C.电子的得失或偏移 D.分子中原子重新组合
26.由NaCl、Na2SO4、KCl组成的混合溶液中,Cl-离子质量为71g,K+离子质量为39g,SO42-离子质量为96g,求溶液中Na+离子的质量。
25.实验室用Cu与HNO3在常温下反应制取NO2气体,同时生成Cu(NO3)2和H2O,试回答:
(1)写出Cu与浓HNO3反应的化学方程式
(2)若实验室想制取23g NO2气体,则需要加入质量分数为63%的浓HNO3多少g?
(3)反应中同时有多少g HNO3被还原?
24.某物质可能含有炭粉、CaCO3、CuO、Fe2O3中的一种或几种。现进行如下实验:
(1)取样品,加热至高温,产生一种能使澄清石灰水变浑浊的无色气体
(2)经冷却后的固体残渣中加入足量的稀盐酸,固体残渣全部溶解,同时产生一种可燃性气体。
根据上述实验现象推断,该物质中一定含有 ,一定不含有 ,可能含有 。写出有关反应的化学方程式,属于氧化还原反应的,标出电子转移的方向和数目,并指出氧化剂、还原剂,属于离子反应的,写出离子方程式:
23.完成下列离子方程式
(1)CO2+( ) CO32-+H2O
CO32-+H2O
(2)( )+Ca2++2OH- CaCO3↓+( )
CaCO3↓+( )
(3)(NH4)2SO4溶液与Ba(OH)2溶液混合加热
(4)Cu和AgNO3的溶液电压
22.标出下列反应的电子转移方向和数目,并填写有关内容:
(1)4FeS+702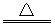 2Fe2O3+4SO2
2Fe2O3+4SO2
氧化剂 ,氧化产物
(2)2S+6KOH 2K2S+K2SO3+3H2O
2K2S+K2SO3+3H2O
氧化剂 氧化产物
还原剂 ,还原产物
离子方程式为:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com