
题目列表(包括答案和解析)
2. 根据阿伏加德罗定律,下列叙述中正确的是
A.同温同压下两种气体的体积之比等于摩尔质量之比
B.同温同压下两种气体的物质的量之比等于密度之比
C.同温同压下两种气体的摩尔质量之比等于密度之比
D.同温同压下两种气体的摩尔质量之比等于压强之比
1. 下列物质中在空气中能稳定存在的是()
A.氯水 B.漂白粉
C.生石灰 D.食盐
35.(4分)某烷烃和烯烃(通式是CnH2n)混合气2.24L(标准状况),点火使其完全燃烧,将燃烧产物通过浓硫酸后,浓硫酸质量增加4.05g; 再通过碱石灰,碱石灰质量增加6.60g;另取等量混合气,通入过量溴水中,溴水质量增加1.05g。
(1)通过计算和分析判断混合气由哪两种烃组成?
34.(4分)某气态烷烃和乙烯等体积混合时,1体积该混合气体完全燃烧消耗4.75体积氧气,
试求:(1)烷烃的化学式。
(2)混合气体中乙烯的质量分数。
33.(5分) 利用碳棒锌片和200ml稀硫酸组成原电池,将化学能转化为电能,当碳棒上共产生3.36L(标准状况)气体时,硫酸恰好全部被消耗。试计算:
(1)有多少个电子通过了导线。
(2)原稀硫酸溶液的物质的量浓度。
32.(6分)海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)海水中含有大量的氯化钠。氯化钠中的非金属元素位于元素周期表第 族。
(2)目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是 (填物理变化、化学变化)
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式为:
2NaCl+2H2O 2NaOH+H2↑+Cl2↑。利用该反应中电解所得气体制36.5%的浓盐酸1000t,最少需要消耗食盐 t。
2NaOH+H2↑+Cl2↑。利用该反应中电解所得气体制36.5%的浓盐酸1000t,最少需要消耗食盐 t。
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下:
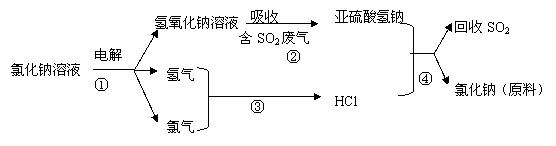
写出②④的化学反应方程式:
31.(6分)下图中各物质均由短周期元素组成,其中只有D、F、G为单质,A为淡黄色固体,B为常见的无色液体,一定条件下D、G和海水为原料可制成海洋电池。

按要求填空:
(1)写出电子式A _____________ B______________
(2)写出化学方程式①_________________________________________________________
②_________________________________________________________
(3)写出D、G和海水制成海洋电池的负极反应式_______________________________。
30.(5分)写出下列变化的化学方程式,并注明反应条件和反应类型。
(1)乙烯和氯化氢 。
(2)苯和浓硝酸 。
(3)苯和液溴 。
(4)苯和氢气 。
(5)丙烯(CH2=CH-CH3)和溴水 。
29.(4分)(1)某烷烃中的碳、氢质量比为5:1,已知该烷烃的一氯代物只有一种,该烃分子的结构简式为 ,名称为 。
(2)0.15mol某气态烷烃完全燃烧需消耗0.75mol氧气,则该烃的分子式为 。
28.(6分) 元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。
 (1)阴影部分元素N在元素周期表中的位置为第 。
(1)阴影部分元素N在元素周期表中的位置为第 。
根据元素周期律,请你预测:H3AsO4、H3PO4 的酸性强
弱 。
(2)元素S的最高正价和最低负价分别为 ,在一定
条件下,S与H2反应有一定限度(可理解为反应进行的程度),
请判断在相同条件下Se与H2反应的限度(选填“更大”、
“更小”或“相同”) 。
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com