
题目列表(包括答案和解析)
13.在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”,凡是有一个手性碳原子的物质一定具有光学活性。例如,有机化合物: 有光学活性,分别发生下列反应①与甲酸发生酯化反应,②与NaOH水溶液共热,③与银氨溶液作用,④在催化剂存在下与H2作用后,生成的有机物无光学活性的是
有光学活性,分别发生下列反应①与甲酸发生酯化反应,②与NaOH水溶液共热,③与银氨溶液作用,④在催化剂存在下与H2作用后,生成的有机物无光学活性的是
A、①② B、②③ C、②④ D、③④
12.将SO2通入BaCl2溶液至饱和,未见沉淀生成,继续通入另一种气体,仍无沉淀,则通入的气体可能是下列中的
A、CO2 B、NH3 C、NO2 D、H2S
11.用铁酸钠(Na2FeO4)对未来河湖的淡水消毒是城市饮用水处理的一种新技术,下列对Na2FeO4用于饮用水消毒处理的分析正确的是
A、Na2FeO4在溶液中显强酸性,能消毒杀菌
B、在Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌
C、Na2FeO4的还原产物Fe3+水解为 Fe(OH)3胶体,可使水中悬浮物凝聚沉降
D、Na2FeO4的还原产物Fe2+水解为Pe(OH)2胶体,可使水中悬浮物凝聚沉降
10.硒(Se)是个导体材料,也是补硒保健品中的元素。工业上提取硒的方法之一是用H2SO4和NaNO3处理合Se的工业废料,而得到亚硒酸(H2SeO4)和少量硒酸(H2SeO4),并使之富集,再将它们与盐酸共热,H2SeO4转化为H2SeO3,主要反应为:
2HCl+H2SeO4=H2SeO3+H2O+Cl2
然后向溶液中通入SO2使硒元素还原为单质硒沉淀,据此正确的判断为
A、H2SeO4的氧化性比Cl2弱 B、SO2的还原性比SeO2弱
C、H2SeO4的氧化性比H2SeO3强 C、浓H2SeO4的氧化性比浓H2SO4弱
9.在25℃时,纯水的电离度为a1,pH=11的氨水中水的电高度为a2,pH=3的盐酸中水的电离度为a3。若将上述氨水与盐酸等体积混合,所得溶液中水的电离度为a4,则下列关系式正确的是
A、a1<a2<a3<a4 B、a3<a2<a1<a4
C、a2<a3<a1<a4 D、a2<a3<a4<a1
8.镍镉充电电池,电极材料是Cd和NiO(OH),电解质是KOH,电极反应分别是:
Cd+2OH--2e=Cd(OH)2
2NiO(OH)+2H2O+2e=2Ni(OH)2+2OH-
下列说法不正确的是
A、电池放电时,负极周围溶液的pH不断增大
B、电池的总反应是Cd+2NiO(OH)+2H2O=Cd(OH)2+2Ni(OH)2
C、电池充电时,镉元素被还原
D、电池充电时,电池的正极和电源的正极相连接
7.在一恒定容积的容器中充入2mol的A和1mol的B发失反应:2A(s)+B(g)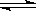 XC(g)。达到化学平衡后,C的体积分数为a。若在恒温恒容下,按0.6mol的A、0.3mol的B、1.4 mol的C为起始物质,达到化学平衡后,C的体积分数仍为a,则X为
XC(g)。达到化学平衡后,C的体积分数为a。若在恒温恒容下,按0.6mol的A、0.3mol的B、1.4 mol的C为起始物质,达到化学平衡后,C的体积分数仍为a,则X为
A、只能为2 B、只能为3 C、可能为2或3 D、无法确定
6.对反应 4NH3(g)+5O2(g)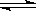 4NO(g)+6H2O(g)+ Q,下列有关叙述正确的是
4NO(g)+6H2O(g)+ Q,下列有关叙述正确的是
A、对NH3与O2的反应来说,化学反应速率关系是3V(NH3)=2V(H2O)
B、若单位时间内生成X mol NO的同时,消耗X mol NH3,则反应达到平衡状态
C、达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D、若降低温度,达到新的化学平衡时,NO的体积分数将增大
5.硼晶体的基本结构单元是棚原子组成的正二十面体,其中,每个面均为正三角形,每个棚原子均与另外五个棚原子相连。由此推断在硼晶体的基本结构单元中的顶点数和棱边数分别是
A、60、12 B、12、30 C、30、12 D、10、30
4.A、B两元素的原子分别得到2个电子形成稳定结构时,A放出的能量大于B放出的能量;C、D两元素的原子分别失去一个电子形成稳定结构时,D吸收的能量大于C吸收的能量。若A、B、C、D间分别形成化合物时,属于离子化合物可能性最大的是
A、D2A B、C2B C、C2A D、D2B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com