
题目列表(包括答案和解析)
5.市售“家用消毒液发生器”是以精盐和自来水为原料,通过时发生器内的电极板上产生大 量气泡(同时使产生的气体充分与电解液接触),所制得的混合液具有强烈的杀菌能力,且不 致对人体造成伤害。该发生器配制消毒液所涉及到的化学反应(反应条件均略)有( )
①2NaCl+2H2O=2NaOH+H2↑+Cl2↑ ②Cl2+2NaOH=NaCl+NaClO+H2O
③H2+Cl2=2HCl ④Cl2+H2O=HCl+HClO
⑤2HClO=2HCl+O2↑
A.①④⑤ B.①② C.③④⑤ D.②③④
4.下列事实不能用勒沙特列原理解释的是( )
A.氨水应密闭保存,放置低温处
B.在硫酸亚铁溶液中,加入铁粉以防止氧化
C.生产硝酸的过程中使用过量的空气以提高氨气的利用率
D.实验室常用排饱和食盐水的方法收集氯气
3.大气或饮用水被污染时,可能引起人的牙齿骨骼变酥,引起这一污染的元素是( )
A.碘 B.氟 C.氯 D.硫
2.在相同温度下等体积、等物质的量浓度的4种稀溶液:①Na2SO3、②H2SO3、③Na HSO3、④Na2S中所含带电微粒由多到少的顺序是( )
A.①=④>③=② B.④=①>③>②
C.①>④>③>② D.④>①>③>②
1.用铜锌合金制成的假金元宝欺骗行人的事件屡有发生。下列不易区别其真伪的方法是( )
A.测定密度 B.放入硝酸中
C.放入盐酸中 D.观察外观
9 HNO3是极其重要的化工原料。工业上制备HNO3是采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的(假定上述过程的每一步反应中无其它损失)。⑴试写出上述反应的化学方程式。⑵设循环操作的次数为n,试计算一定量的NO2气体要经过多少次循环操作才能使95%的NO2转变为硝酸?⑶将上述方法制备的硝酸稀释或蒸馏、浓缩,可以得到不同浓度的硝酸。实际上,不同浓度的硝酸与同一种金属反应可生成不同的还原产物。如图是镁与硝酸反应,各产物及含量随硝酸浓度变化的情况(当硝酸浓度小于10mol·L-1时还有NH4+生成),写出镁与11mol·L-1硝酸反应的化学方程式。⑷960mg镁与100mL4mol·L-1硝酸溶液恰好完全反应,收集到224mL气体(STP),试写出该反应化学方程式。
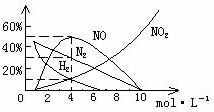
分析:⑴ 3NO2+H2O=2HNO3+NO,2NO+O2=2NO2。⑵ 从反应式可知,NO2跟水第一次反应中有2/3转化为硝酸,经循环氧化后所得的NO2跟水第二次反应中有2/3×1/3转化为硝酸……,那么,经n次循环后转化为硝酸的总量:S=2/3+2/3×1/3+2/3×(1/3)2+2/3×(1/3)3……+2/3×(1/3)n=1-(1/3)n,列式,1-(1/3)n=95%,解得n≈3。⑶ 看图,当硝酸的浓度超过10mol·L-1时,还原产物只有NO2,所以,其反应方程式为:Mg+4HNO3=Mg(NO3)2+2NO2↑+2H2O。⑷ 看图,当硝酸跟4mol·L-1硝酸反应时,生成的NO、NO2、H2、N2的物质的量之比为5﹕1﹕1﹕3,又据题意,当硝酸浓度小于10mol·L-1时还有NH4+生成,所以,其反应方程式为:40Mg+100HNO3=5NO+H2+NO2+3N2+4NH4NO3+40Mg(NO3)2+41H2O。
8 工业上用铜屑和浓硝酸为原料制取硝酸铜。在实际生产中,需把浓硝酸用等体积的水稀释。试简要回答下列问题:⑴ 用稀硝酸而不用浓硝酸的原因是 。⑵ 从经济效益和环境保护角度考虑,设计制取硝酸铜最适宜的方法,用化学方程式表示为 。
分析:⑴ 比较稀硝酸、浓硝酸分别与铜反应的方程式,Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;发现生成等物质的量的硝酸铜,用稀硝酸时,消耗原料较少,且产生污染物的量也较少。⑵ 2Cu+O2=2CuO;CuO+2HNO3=Cu(NO3)2+H2O。
4 牙膏中配有氟化物添加剂以防止龋齿的原因是,长期使用加氟牙膏在牙齿表面生成了一层质地坚硬溶解度小的氟磷酸钙。已知氟磷酸钙化学式中除钙离子外还有3个PO43–离子,一个F–离子,则其化学式是( )
A、Ca5(PO4)3F B、Ca3(PO4)3F C、Ca2(PO4)3F D、Ca6(PO4)3F
分析:根据化合价知识,易知答案为A。
5 市面上销售的金首饰是否属于纯金,可取样品与某试剂进行反应,根据现象即可判断,该试剂是( )
A、盐酸 B、硝酸 C、王水 D、硫酸
分析:本题主要考查金与酸反应的知识。能反应且现象明显的只有硝酸,所以答案为B。
6 高级轿车中装有安全气囊,内部贮存化学物质。当汽车高速前进过程中受到撞击时,化学物质会在瞬间爆发产生大量气体,充满气袋,填补在乘员与挡风玻璃、仪表板、方向盘之间,防止乘员受伤。⑴ 如果气袋内贮有硝酸铵,它受猛烈冲击后能迅速分解,产生大量N2O气体,试写出其化学方程式 。⑵ 若需要产生30dm3的N2O气体,需要贮备 mol的硝酸铵。
分析:⑴ 2NH4NO3==2N2O+4H2O。⑵ 要产生30dm3的N2O需要N2O的物质的量为30/22.4=1.34mol。由上述方程式可知,产生1molN2O需要1mol的NH4NO3,所以产生30dm3的N2O需要1.34×1=1.34(mol)的NH4NO3。
7 雷鸣电闪是日常生活中司空见惯的现象。设某次雷电中,两块云团间的电势差约为109V,放电电量约为30C。在闪电过程中,空气中有氮气和氧气直接化合,已知每摩氮气和氧气化合时要吸收180.74kJ的能量,闪电时有1/1000的能量用于这一反应。试求:⑴ 此次闪电所产生NO的物质的量为 mol。⑵ 此次雷雨闪电的生成物相当于给土壤施
了 kg尿素。
分析:⑴ 此次闪电放出的能量为E=qU=109×30=3×1010(J),根据反应方程式N2+O2=2NO,知所产生NO的物质的量为n=E总/E=3×1010×10-3×2/(180.74×103)=332(mol)。⑵ 根据氮元素守恒有关系式2NO----CO(NH2)2,可以求生成尿素的总质量为332×60/2=9960(g)=9.96kg。
3 酸雨是由于大气中SO2和NOx(NO和NO2)的含量不断升高,并转变为H2SO4和HNO3(主要是H2SO4)随雨水降落而形成的。为防止污染,硫酸厂用氨水来吸收SO2,离子方程式为 ;硝酸厂可用烧碱溶液来吸收氮的氧化物,如NO2被烧碱溶液吸收生成NaNO2和NaNO3,离子方程式为 ;也可用氨的催化还原法把氮的氧化物变成氮气,还原1体积的NOx需要 体积氨气。
分析:前两问的答案依次为,2NH3·H2O+SO2=2NH4++SO32-+H2O。2NO2+2OH–=NO2–+NO3–+H2O。用氨的催化还原的方程式为3NOx+2xNH3=(x+3/2)N2+3xH2O,则每还原1体积的NOx需要2x/3体积的氨气。
 1 高空大气中O2吸收紫外线可变成臭氧(O3),而冰箱中的致冷剂氟里昂在紫外线作用下分解出氯原子,氯原子能加速臭氧的分解,从而破坏平流层中的臭氧层。同样超音速飞机的尾气及发动机尾气中的NO也能加快的O3分解,反应式如下:NO+O3→NO2+2O;NO2+O→NO+O2。请你写出总的反应式:
;其中NO的作用是
和
。
1 高空大气中O2吸收紫外线可变成臭氧(O3),而冰箱中的致冷剂氟里昂在紫外线作用下分解出氯原子,氯原子能加速臭氧的分解,从而破坏平流层中的臭氧层。同样超音速飞机的尾气及发动机尾气中的NO也能加快的O3分解,反应式如下:NO+O3→NO2+2O;NO2+O→NO+O2。请你写出总的反应式:
;其中NO的作用是
和
。
分析:通过化学反应方程式的加和可以得到总的反应式:O3 O2+O。通过第一个反应式可知NO作还原剂,由总反应式可知NO作催化剂。
2 我国沿海出现了大面积赤潮,它造成的严重后果是 。赤潮是水体富营养化的结果,主要是因为滥用 等,使水中含有大量的 元素对应的离子。为了防止水污染,我国许多地区已经对洗衣粉的成分加以限制,不得再销售使用的洗衣粉中主要含有 (从下述选项中选)。
A、硅酸钠 B、烷基苯磺酸钠 C、三聚磷酸钠 D、蛋白质
分析:赤潮是红藻、蓝藻等在较短时间内大量繁殖形成的,在此期间,藻类分泌毒素,并且消耗水中的溶解氧,造成水质恶化和鱼类死亡。水体富营养化是因为滥用氮肥、磷肥、农药和城镇废水排放等,使水中含有大量的氮、磷元素。含磷洗衣粉是严禁使用的,其中含有三聚磷酸钠。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com